
摘要
目的: PCSK9主要由肝臟分泌到迴圈中,與低密度脂蛋白受體(LDLR)的同源和非同源受體(包括CD36)交互作用,從而有利於它們在細胞內降解。由於PCSK9缺乏會增加脂質和脂蛋白受體的表達,從而促進細胞脂質積累,我們研究了這是否會影響心臟代謝和功能。
方法和結果: 用標準脂肪飲食餵養野生型(WT)、Pcsk9 KO、肝臟條件性Pcsk9 KO和Pcsk9/Ldlr雙KO雄性小鼠20周,然後評估運動耐量、肌肉力量和心臟特性。 Pcsk9 KO表現為跑步耐量減低,並伴有心臟超音波異常,提示射血分數保留的心力衰竭(HFpEF)。 與WT小鼠相比,在最大耦合和非耦合呼吸後,Pcsk9KO小鼠的心臟粒線體活性降低,並且與心臟代謝的主要變化以及LDLR和CD36的表達增加以及脂質積累有關。在Pcsk9/Ldlr DKO中觀察到類似的表型,因此排除了LDLR導致Pcsk9 KO小鼠中觀察到的心臟損傷的可能。肝臟選擇性Pcsk9 KO模型的心臟功能分析進一步排除了迴圈PCSK9在HFpEF開發中的作用,表明局部產生的PCSK9可能發揮作用。同時,與匹配的對照受試者相比,PCSK9的R46L功能喪失變體的攜帶者左心室品質增加,但射血分數相似。
結論: PCSK9缺乏透過一種不依賴LDLR的方式影響心臟脂質代謝,並有助於HFpEF的發展。
名詞解釋
PCsk9(proprotein convertase subtilisin / kexin type 9): 前蛋白轉化酶枯草溶菌素9
HFpEF(heart failure with preserved é jection fraction): 射血分數保留的心力衰竭。射血分數保留的心衰(HFpEF)指心臟射血分數正常或接近正常(>0.5或0.45)但有癥狀或體征和臨床表現的心力衰竭,其並非一種特異性的診斷或症候群,它是由多種疾病(排除非源性因素)引起的一組癥候群。
ATP(adenosine triphosphate): 三磷酸腺苷
LDLR(low - density lipoprotein receptor): 低密度脂蛋白受體
VLDLR(very low - density lipoprotein receptor): 極低密度脂蛋白受體
WT(wild - type): 野生型
FA(fatty acid): 脂肪酸
LPL(lipoprotein lipase): 脂蛋白脂肪酶
PPARα(peroxisome proliferator-activated receptor alpha): 過氧化體增殖劑啟用受體α
PPARγ(peroxisome proliferator-activated receptor gamma): 過氧化體增殖劑啟用受體γ
TAG(triacylglycerol): 甘油三酯
GPI( glycosylphosphatidylinositol): 糖基磷脂酰肌醇
LVPW(left ventricular posterior wall): 左心室後壁
ETC(electron transport chain): 電子傳遞鏈
前言
心臟主要利用有氧代謝來滿足其能量需求,其中大部份三磷酸腺苷(ATP)是在脂肪酸(FA)氧化後產生的。
與肝臟不同,心臟不能合成大量FA,因此,FA的需求主要從迴圈中攝取來支持,其中FA以遊離FA形式與白蛋白結合或以脂蛋白中的甘油三酯形式運輸。然後透過脂蛋白脂肪酶(LPL)的活性將FA從白蛋白中解離或從脂蛋白中釋放出來,並透過FA轉運蛋白或FA轉位酶(如CD36)遞送至心肌細胞。脂蛋白透過與包括極低密度脂蛋白受體(VLDLR)在內的細胞表面特定受體交互作用,將FA和膽固醇輸送至心肌細胞。
心臟脂質需求是一個精細調節的過程,它平衡脂質攝取和粒線體β-氧化以支持心臟代謝,同時需要防止過度的脂質累積——反而會導致心肌細胞功能障礙。在心力衰竭患者中,心肌細胞轉為糖解作用作為ATP生成的首選途徑,從而促進細胞三酸甘油酯(TAG)的累積。
在代謝症候群和糖尿病患者中,乳酸、酮體或胺基酸被用作替代FAs的能量來源。在分子水平上,一方面TAG累積和FA超載促進心肌細胞中的粒線體功能障礙和氧化磷酸化解偶聯,另一方面促進脂毒性物質的產生,包括二酰基甘油、長鏈酰基輔酶A、酰基肉堿和溶血磷脂,導致心力衰竭。
一些實驗觀察提供了脂質累積和心臟功能障礙之間的聯系。缺乏脂肪甘油三酯脂肪酶的小鼠表現出明顯的心臟TAG累積,同時伴連心力衰竭和過早死亡。相似地,過氧化體增殖物啟用受體α(PPARa)和γ(PPARγ)的過度表達會增加FA氧化,但導致FA攝取超過氧化引起的心臟脂質代謝失衡,從而導致脂質累積。
與之一致的,在心肌細胞中選擇性表達糖基磷脂酰肌醇(GPI)錨定的人LPL(aMHC-LpLGPl)小鼠增加了心臟攝取和來自迴圈脂蛋白(包括甘油三酯、FA和膽固醇)的脂質累積。
所有這些數據都與以下概念一致,即促進參與脂質攝取途徑的活性可能有助於心臟脂質超負荷和毒性,並表明增加心臟中脂蛋白受體表達的因素可能導致心臟功能障礙,如缺氧誘導VLDLR介導的心臟脂毒性。
前蛋白轉化酶枯草桿菌蛋白酶/kexin 9型(PCSK9),一種692個胺基酸的糖蛋白,已知可控制低密度脂蛋白受體(LDLR)再迴圈。除LDLR外,PCSK9還靶向LDLR的同源和非同源受體,包括VLDLR15、ApoER2(LRP8)、LRP1和CD36,並透過抑制內體﹣溶酶體區室中脂蛋白的解離來破壞它們的再迴圈,從而促進他們的退化。因此,增加的PCSK9水平會導致這些受體的再迴圈減少,這一發現在肝臟中得到了廣泛的研究。
然而, PCSK9可發揮肝外效應:它的缺乏與胰腺細胞功能受損和人類患糖尿病的風險增加相關。 值得註意的是,Pcsk9 KO小鼠的體重增加和內臟脂肪組織沈積,這一發現在PCSK9功能喪失變體的攜帶者中得到證實。觀察到這些受試者還表現出心外膜脂肪組織增加,再加上PCSK9在控制參與心臟脂蛋白攝取的關鍵受體中的關鍵作用,為研究PCSK9缺乏是否影響心臟脂質代謝和功能提供了理論依據。
為此,我們在保留胰島素反應的實驗條件下測試了PCSK9缺乏對心臟代謝和功能的影響。以標準脂肪飲食餵養Pcsk9 KO小鼠20周,我們觀察到PCSK9缺乏會影響心臟中的脂質代謝和能量產生,導致左心室壁增厚和射血分數保留的心力衰竭(HFpEF)的進展。為了進一步研究這一觀察結果在臨床環境中的影響,在攜帶PCSK9功能喪失多型性的受試者中進行了心功能研究。
方法
關於小鼠、心臟超音波分析、疲勞測試、前肢抓握測試、耗氧率、代謝組學、蛋白質組學、蛋白質組學、蛋白質墨點分析、心臟組織中膽固醇積累的分析、血漿劑量、生物資訊學和統計分析的詳細描述於線上補充材料中提供。
結果
PCSK9缺乏與射血分數保留的心力衰竭有關
為了研究PCSK9對全身和細胞脂質和脂蛋白代謝的影響是否可能影響心臟功能,我們評估了餵食標準脂肪飲食20周的PCSK9 KO和野生型(WT)雄性小鼠的心臟形態。Pcsk9 KO小鼠心臟的心超分析(圖1A)顯示,與WT小鼠(圖1B和C)相比,在收縮期和舒張期期間左心室後壁(LVPW)的厚度增加,盡管兩組之間的總體重沒有差異(線上補充材料,圖S1A)。
盡管與野生型小鼠相比,Pcsk9 KO小鼠中的左心室品質(圖1E)和射血分數(圖1F)的歸一化相似,但相對壁厚增加(圖1D),因此提示心臟存在同心重構。為了評估這種情況是否與心臟功能受損有關,在WT和Pcsk9 KO 小鼠中行疲勞測試中的運動不耐受和跑步耐量試驗。與WT小鼠相比,後者在疲勞測試中觀察到的跑步距離和跑步時間顯著減少(圖1G和H)。
值得註意的是,這種表型不是骨骼肌效能降低的結果,因為在前肢抓握測試(圖1I)中觀察到了類似的結果,並且Pcsk9 KO和WT小鼠之間比目魚肌的耗氧率沒有差異(線上補充材料,圖S1B)。這些數據表明Pcsk9 KO呈現出HFpEF的特征。
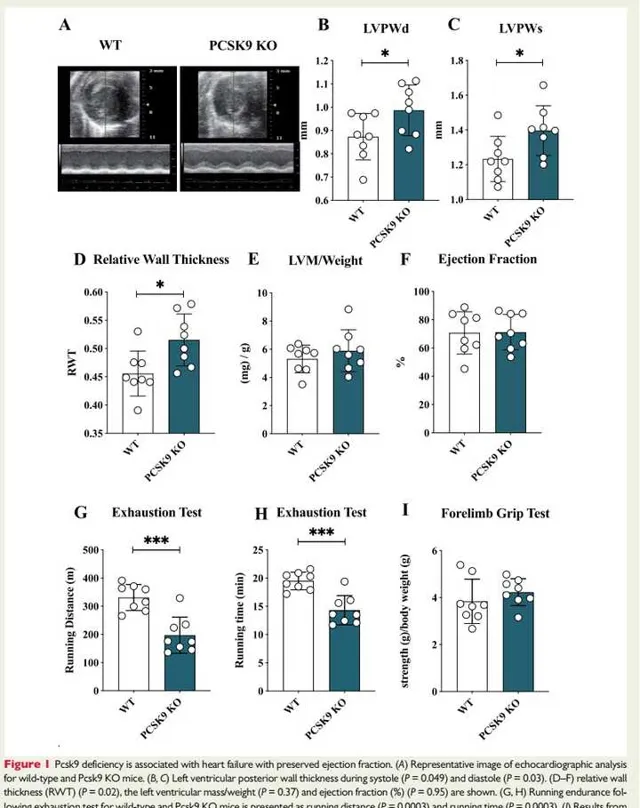
圖1:Pcsk9缺乏與射血分數保留的心力衰竭有關。
圖1A:WT和Pcsk9 KO小鼠心臟超音波分析影像。
圖1B和C:分別為收縮期和舒張期期間的小鼠左心室後壁厚度(LVPW)。結果發現:與WT小鼠相比,在收縮期和舒張期期間Pcsk9 KO小鼠LVPW的厚度增加。
圖1D:為心超顯示的相對壁厚,結果提示:與WT小鼠相比,Pcsk9 KO小鼠相比壁厚增加。
圖1E:為左心室品質/體重,提示與WT小鼠相比,Pcsk9 KO小鼠該比值增大(盡管未達到統計學差異)。
圖1F:為射血分數(%),結果提示,Pcsk9 KO小鼠與WT小鼠的射血分數無顯著差異。
圖1G和H:為WT和Pcsk9 KO小鼠在疲勞測試的跑步耐力,表現為跑步距離(1G)和跑步時間(1H)。結果提示:與WT小鼠相比,Pcsk9 KO小鼠在疲勞測試中觀察到的跑步距離和跑步時間均顯著減少。
圖1:顯示了前肢抓地力測試的結果,提示WT和Pcsk9 KO小鼠骨骼肌效能近似。綜上,Pcsk9 KO小鼠呈現射血分數保留的心力衰竭,提示Pcsk9缺乏與射血分數保留的心力衰竭有關。
PCSK9缺陷小鼠的心臟粒線體代謝發生改變
鑒於PCSK9在細胞脂質生物學中的關鍵作用,我們接下來評估PCSK9缺乏對心臟脂質代謝的影響及其與心臟能量需求的相關性。與最大耦合和非耦合呼吸下的對照小鼠相比,來自Pcsk9 KO小鼠的新鮮分離的心臟表現出氧消耗率的顯著降低(圖2A)。這一發現,加上在Pcsk9 KO小鼠中觀察到的電子傳遞鏈(ETC)復合物11的活性降低(線上補充材料,圖S2A和B),促使我們測試 ATP 的產生是否受到影響。
與WT同窩對照以及其他參與能量產生的輔助因子相比,Pcsk9 KO 鼠心臟中的ATP水平(圖2B)和ATP能量電荷(圖2C)降低(線上補充材料,圖S2D-K)。此外心臟組織的詳細蛋白質組學分析表明,與WT(線上補充材料,圖S2A)相比,Pcsk9 KO心臟中幾種粒線體蛋白的表達受到影響,包括ETC復合物的關鍵結構成分(圖2D)。
透過對代表每個粒線體復合物的蛋白質(包括NADH泛醌氧化還原酶亞基B8(Ndufb8﹣復合物Ⅰ)、琥珀酸去氫酶復合物亞基B(Sdhb-復合物Ⅱ)和泛醇-細胞色素C還原酶核心蛋白2(Uqcrc2-complex Ⅲ))進行蛋白質墨點分析,發現與WT同窩對照相比,在Pcsk9 KO小鼠的心臟中上述蛋白表達顯著減少(圖2E和F),從而進一步證實了這一發現。
這一發現連同復合物Ⅱ活性的降低(線上補充材料,圖S2B)支持FADp進入ETC效率較低這一結果的可能性,該過程可能會影響FA分解代謝。同時,粒線體DNA拷貝數也減少(線上補充材料,圖S2C),表明Pcsk9 KO小鼠的心臟中粒線體功能和含量受到影響。
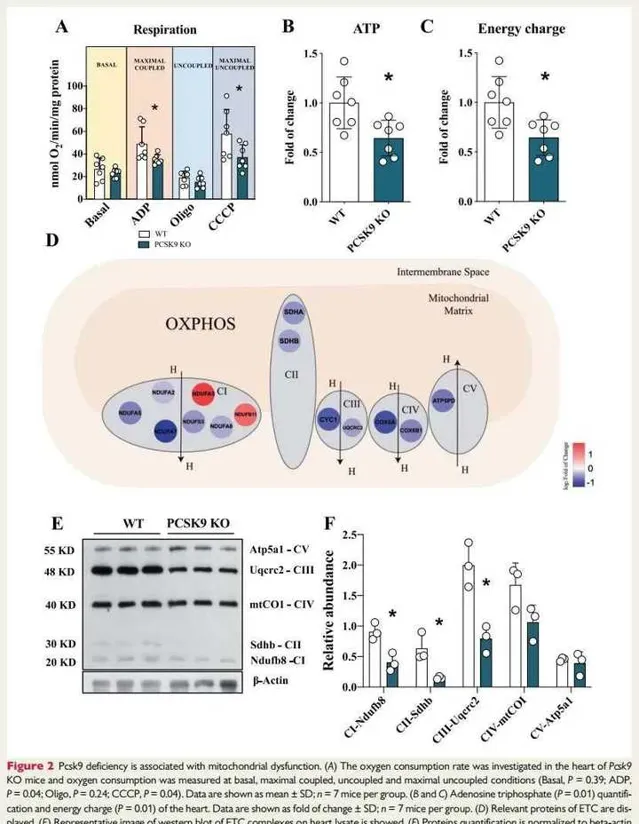
圖2:Pcsk9缺乏與粒線體功能障礙有關。
圖2A:在Pcsk9 KO小鼠的心臟中研究耗氧率,並分別在基礎( Basal )、最大耦合(ADP)、非耦合(Oligo)和最大非耦合(CCCP)條件下測量耗氧量。結果發現:在最大耦合和最大非耦合呼吸條件下,與WT小鼠相比,Pcsk9 KO小鼠新鮮分離的心臟中表現出氧消耗率的顯著降低。
圖2B和C:為ATP定量和心臟的ATP能量電荷定量。數據顯示為變化倍數。結果提示:與WT同窩對照以及其他參與能量產生的輔助因子相比,Pcsk9 KO小鼠心臟中的ATP水平(圖2B)和ATP能量電荷(圖2C)降低。
圖2D:顯示了ETC相關的蛋白質。與WT相比,Pcsk9 KO小鼠心臟中ETC復合物的關鍵結構成分蛋白質表達下調。
圖2E:顯示了ETC復合物的蛋白質墨點影像。
圖2F:為蛋白品質化(對β-肌動蛋白表達的相比豐度)。結果提示:透過對代表每個粒線體復合物的蛋白質(包括NADH泛醌氧化還原酶亞B8(Ndufb8-復合物)、琥珀酸去氫酶復合物亞基B(Sdhb-復合物Ⅱ)和泛醇﹣細胞色素 C 還原酶核心蛋白2(Uqcrc2-complexⅢ))進行蛋白質墨點分析,發現與WT同窩對照相比,在Pcsk9 KO小鼠的心臟中上述蛋白表達顯著減少。綜上,Pcsk9 KO小鼠的心臟中粒線體功能和含量受到影響。
我們接下來研究這是否會轉化為心臟代謝的改變。Pcsk9 KO和WT小鼠心臟中代謝組學、蛋白質組學和脂質組學特征的綜合分析(圖3A和線上補充材料,圖S3)顯示粒線體活性受損的原因是:
①FA氧化受損——攜帶中鏈FA(C8和C10)的酰基肉堿的增加與β-氧化酶的減少,如甾醇攜帶蛋白2(SCP2)、烯酰輔酶A水合酶和短鏈1(ECHS1)(圖3A和線上補充材料,圖S3C和D);
②降低三羧酸(TCA)迴圈通量減少——TCA中間體和催化關鍵酶的酶水平降低(圖3A和線上補充材料,圖S3A和E)。
葡萄糖-6P水平的降低(圖3A和線上補充材料,圖S3B和F)和乳酸去氫酶水平的增加以及乳酸血漿水平的增加(圖3A)進一步證實了向無氧代謝的轉變。然而,這不足以支持心臟能量需求;的確,我們觀察到與WT相比,Pcsk9 KO小鼠心臟中能量電荷凈減少(圖2C)。
一致地,心臟蛋白質組的功能通路分析顯示,與無法維持細胞能量需求相關的心臟功能障礙增加(圖3B)。粒線體電子顯微鏡分析WT和Pcsk9 KO心臟,發現與WT相比,Pcsk9 KO心臟中心肌細胞中粒線體脊的密度和組織性較低(圖3C)。
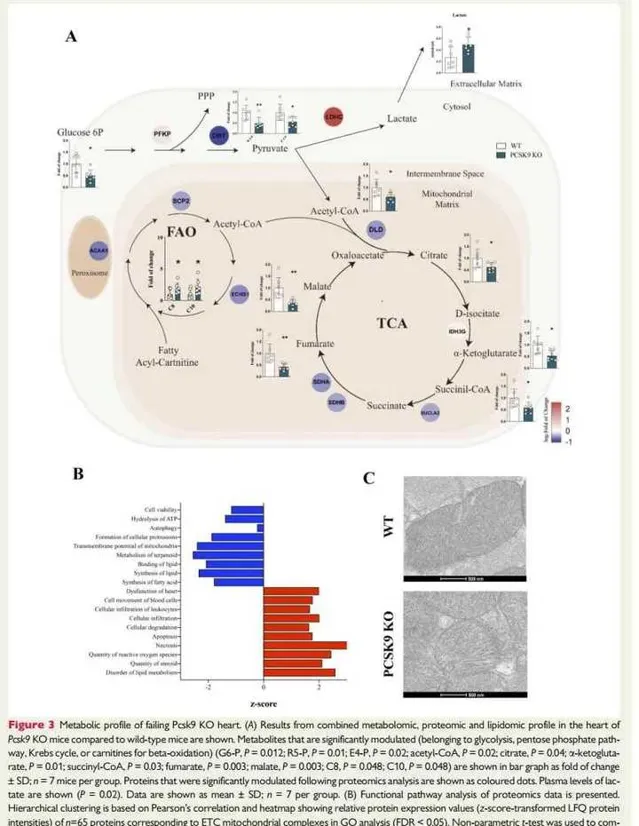
圖3:Pcsk9 KO小鼠衰竭心臟的代謝特征。
圖3A:顯示WT和Pcsk9 KO小鼠心臟中組合代謝組學、蛋白質組學和脂質組學特征的綜合分析。蛋白質組學分析後顯著調節的蛋白質顯示為彩色點。結果顯示:顯示粒線體活性受損的原因是:
①FA氧化受損——攜帶中鏈FA(C8和C10)的酰基肉堿的增加與β-氧化酶的減少,如甾醇攜帶蛋白2(SCP2)、烯酰輔酶A水合酶和短鏈1(ECHS1);
②降低三羧酸(TCA)迴圈通量減少——TCA中間體和催化關鍵酶的酶水平降低。葡萄糖-6P水平的降低和乳酸去氫酶水平的增加以及乳酸血漿水平的增加進一步證實了向無氧代謝的轉變。
圖3B:顯示了蛋白質組學數據的功能通路分析。分層聚類基於Pearson相關性和熱圖,顯示了與GO分析中ETC粒線體復合物相對應的65種蛋白質的相對蛋白質表達值(z分數轉換的LFQ蛋白質強度)。結果顯示:無法維持細胞能量需求相關的心臟功能障礙增加。
圖3C:顯示了透過透射電子顯微鏡獲得的心肌粒線體的代表性顯微照片。結果發現:與WT相比,Pcsk9 KO心臟中心肌細胞中粒線體脊的密度和組織性較低。
PCSK9缺乏導致心臟中LDLR和CD36表達增加以及脂質累積
為了進一步了解心臟功能障礙表型背後的分子機制,我們研究了心臟中PCSK9關鍵靶標的表達。與WT同窩對照相比,Pcsk9 KO小鼠中LDLR和CD36的表達均增加(圖4A和 B )。值得註意的是,心臟的透射電子顯微鏡分析顯示WT和Pcsk9 KO小鼠中縱向肌原纖維和規則插入的閏盤圖(4C和D)。
然而,Pcsk9 KO心臟呈現出豐富的與粒線體緊密相聯的脂滴(圖4D),這一特征在WT小鼠中幾乎不存在(圖4C)。這一觀察結果進一步支持了Pcsk9 KO小鼠心臟中脂質累積的存在。超薄切片的定量分析表明,Pcsk9 KO小鼠心臟中的脂滴數量(圖4E和線上補充材料,圖S4A)以及脂滴直徑(圖4F)均顯著增加。
此外,與WT同窩對照相比,在Pcsk9 KO小鼠心臟中觀察到總膽固醇(圖4G)和花生四烯酸水平(線上補充材料,圖S4B)增加,但總甘油三酯含量相似(圖4H)。正如預期的那樣,與WT小鼠相比,Pcsk9 KO小鼠的血漿膽固醇和甘油三酯水平較低(線上補充材料,圖S3G和H)。
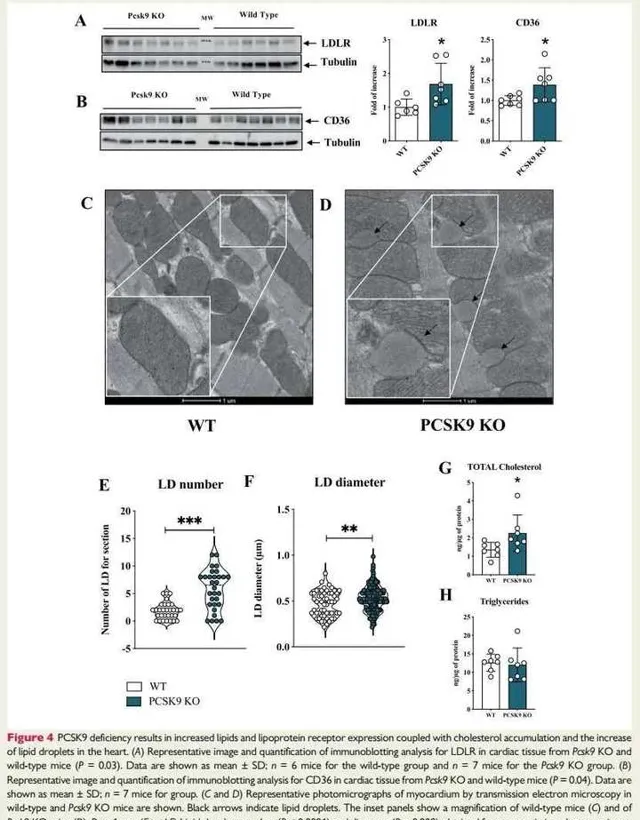
圖4:PCSK9缺乏導致脂質和脂蛋白受體表達增加,並伴有膽固醇積累和心臟中脂滴的増加。
圖4A:Pcsk9 KO和WT小鼠心臟組織中LDLR免疫墨點分析的代表性影像和量化結果。結果提示:與WT同窩對照相比,Pcsk9 KO小鼠中LDLR表達增加。
圖4B:為Pcsk9 KO和WT小鼠心臟組織中CD36免疫墨點分析的代表性影像和量化結果。結果顯示:與WT同窩對照相比,Pcsk9 KO小鼠中CD36表達增加。
圖4C和D:顯示了在WT和Pcsk9 KO小鼠中透過透射電子顯微鏡觀察心肌的代表性顯微照片。黑色箭頭表示脂滴。結果提示:心臟的透射電子顯微鏡分析顯示WT和Pcsk9 KO小鼠中縱向肌原纖維和規則插入的閏盤。然而,Pcsk9 KO心臟呈現出豐富的與粒線體緊密相聯的脂滴,這一特征在WT小鼠中幾乎不存在。這一觀察結果進一步支持了Pcsk9 KO小鼠心臟中脂質累積的存在。
圖4E和F:為透射電子顯微鏡分析中獲得的脂滴數和直徑。結果提示:Pcsk9 KO小鼠心臟中的脂滴數量以及脂滴直徑均顯著增加。
圖4G和H:分別顯示了心內總膽固醇和甘油三酯水平。結果提示:與WT同窩對照相比,在Pcsk9 KO 小命心臟中觀察到總膽固醇(圖4G)增加,但總甘油三酯含量相似(圖4H)。PCSK9缺乏導致心臟中LDLR和CD36表達增加以及脂質積累。
觀察到脂滴數量和膽固醇含量增加,加上Pcsk9 KO小鼠心臟中LDLR受體表達增加,表明LDLR在促進心臟脂質累積方面可能發揮作用。為了驗證這一假設,我們對缺乏PCSK9和LDLR(DKO)小鼠的心臟功能、形態和代謝進行了表征。
與Ldlr KO小鼠相比,DKO小鼠在疲勞測試中觀察到的跑步距離和時間顯著減少(圖5A和B);這種效果不依賴於骨骼肌力量的差異,因為前肢抓地力的測試結果相似5C)。
值得註意的是,與WT相比,Ldlr KO小鼠的心臟左心室品質/重量和收縮期心臟LVPW厚度顯著降低(左心室品質/重量:WT 5.31±0.98與Ldlr KO 4.10±0.91,P =0.04)( LVPW:WT 1.23±0.13 Vs . Ldlr KO 1.10±0.08,P=0.04)(線上補充材料,表S1),這一發現與他們跑步耐量較差(與 WT 相比)一致(跑步距離:WT 331.1±46.20與 Ldlr KO 245.3±40.93m,P=0.049)(補充材料線上,圖S5A-C)。
另一方面, DKO和Pcsk9 KO小鼠心臟超音波觀察到的特征非常相似(圖1B和5C),表明PCSK9對心臟功能的影響不依賴於LDLR表達的調節和血漿膽固醇水平的變化(線上補充材料,圖S5D和 E )。事實上,心臟超音波分析表明,與 Ldlr KO小鼠相比, DKO小鼠在收縮期(圖5D)表現出左心室顯著增厚,而射血分數沒有改變(圖5E)。
此外,代謝分析表明,與Ldlr KO小鼠相比, DKO小鼠的ATP水平胡能量電荷仍顯著降低(圖5F和G)。該曲線與TCA迴圈流量減少以及心臟粒線體功能障礙(圖5H)以及血漿乳酸水平升高一致(圖51和線上補充材料,圖S5F)。這些數據強烈支持這樣一個概念,即PCSK9缺乏引起的心臟LDLR表達增加與觀察到的表型無關。
為了進一步了解PCSK9與心肌細胞生理學之間的聯系,我們對從人類多能幹細胞(iPSC-CM)中分化而來不同的心肌細胞進行了一系列研究。心肌細胞表型的確認透過肌鈣蛋白T表達的增加(高達300倍)來證明(線上補充材料,圖S6A)。
與在對照培養基中生長的細胞相比,補充VLDL導致PSC-CM中LDLR 、CD36、 LPL、4型葡萄糖轉運蛋白(GLUT4)禾和 FA 合酶的mRNA表達顯著增加(線上充材料,圖S6B)。此外,VLDL處理導致粒線體品質減少(線上補充材料,圖S6C)和中性脂質累積增加(線上補充材料,圖S6D)。
當用PCSK9(線上補充材料,圖S6E和 F )對心肌細胞進行預處理時,這些效應被逆轉,證實了PCSK9在調節心肌細胞脂質攝取和粒線體功能中的作用。與這些發現一致,與WT相比,VLDL處理的Pcsk9 KO小鼠心臟分離的原代心肌細胞中顯示粒線體品質減少,對於分離出的Pcsk9/Ldlr DKO的原代心肌細胞也是如此(線上補充材料,圖S6G),因此進一步排除了觀察表型中的LDLR的作用。
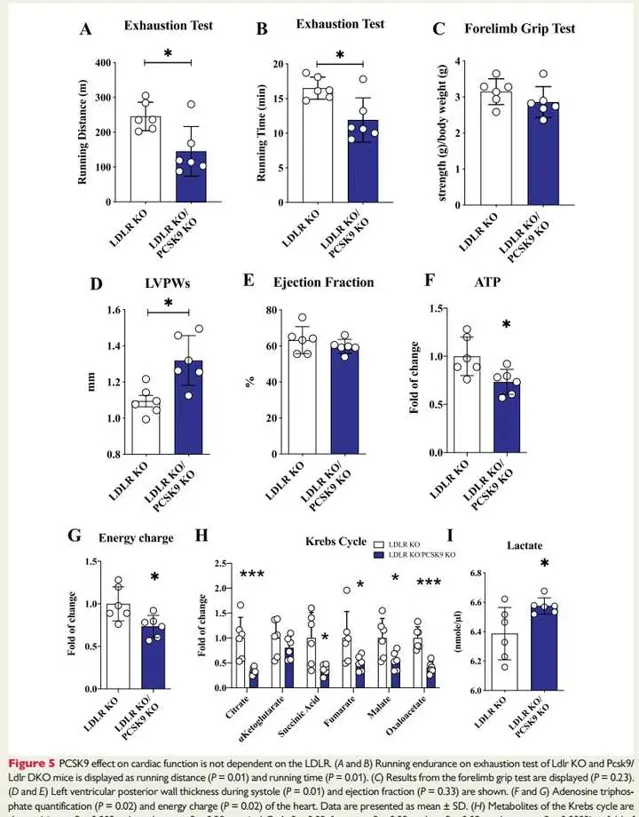
圖5:PCSK9對心臟功能的影響不依賴於LDLR。
圖5A和B:為Ldlr KO和Pcsk9/Ldlr DKO小鼠疲勞測試:分別為跑步距離和跑步時間。結果提示:與Ldlr KO小鼠相比, DKO小鼠在疲勞測試中觀察到的跑步距離和時間顯著減少。
圖C:顯示前肢抓地力測試結果,提示DKO小鼠的運動耐量降低不依賴於骨骼肌力量的差異,因為前肢抓地力的測試結果與Ldlr KO小鼠相似。
圖5D和E:顯示收縮期左心室後壁厚度和射血分數。結果提示:與Ldlr KO小鼠相比, DKO小鼠在收縮期表現出左心室顯著增厚(D),而射血分數沒有改變(E)。
圖5F和G:為心臟的 ATP 定量和能量電荷。結果提示:與Ldlr KO小鼠相比, DKO小鼠的 ATP 水平胡能量電荷均顯著降低。
圖5H:顯示TCA迴圈的代謝物(檸檬酸鹽,α-酮戊二酸,琥珀酰輔酶A,富馬酸,蘋果酸,草酰乙酸)的變化。結果提示TCA迴圈流量減少以及心臟粒線體功能障礙。圖5顯示乳酸的血漿水平。結果提示:與 Ldlr KO小鼠相比,DKO小鼠的血漿乳酸水平升高。綜上,PCSK9對心臟功能的影響不依賴於LDLR。
迴圈PCSK9不影響心臟代謝
在人類和小鼠中,迴圈PCSK9主要來源於肝臟。因此,為了區分迴圈與局部產生的PCSK9對心臟功能的影響,我們分析肝臟中PCSK9選擇性缺乏的小鼠(AlbCre +/Pcsk9LoxP/LoxP小鼠,僅缺乏迴圈PCSK9)的心臟功能和心臟形態。與 AlbCre-/Pcsk9LoxP/LoxP小鼠相比,AlbCre+/Pcsk9LoxP/LoxP小鼠在疲勞測試中觀察到的跑步距離和跑步時間相似(圖6A和B),肌肉表現也相似(圖6C)。
因此,收縮期左心室厚度(圖6D)、射血分數(圖6E)以及幾個心臟參數(線上補充材料,圖S7A-E)沒有出現差異。此外,ATP產生(圖6F)、ATP能量電荷(圖6G)、三羧酸迴圈代謝物(圖6H)和糖解作用中間體(線上補充材料,圖S7F)在這些小鼠的心臟中沒有差異。
與AlbCre-/Pcsk9LoxP/LoxP對照小鼠相比,AlbCre+/Pcsk9LoxP/LoxP小鼠的迴圈乳酸水平(圖6J)和甘油三酯(線上補充材料,圖S7G)未受影響,而肝臟選擇性KO小鼠中的膽固醇顯著降低(線上補充材料,圖S7H)。 這些數據排除了在觀察表型中肝臟產生(即迴圈)PCSK9缺乏的作用,提示局部產生的PCSK9缺乏是心臟功能障礙的驅動因素。
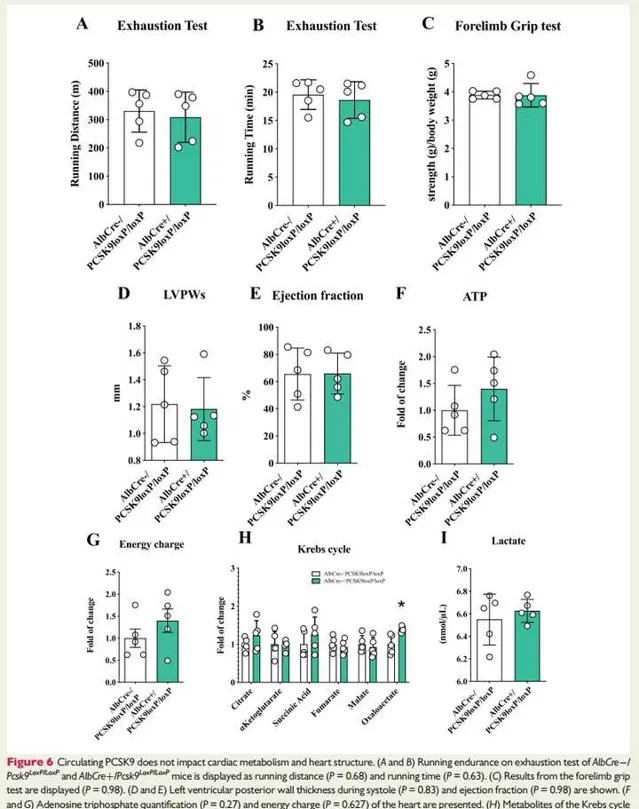
圖6:迴圈PCSK9不會影響心臟代謝和心臟結構。
圖6A和B:為 AlbCre -/Pcsk9 LoxP/LoxP和AlbCre +/Pcsk9 LoxP/LoxP小鼠疲勞測試:分別為跑步距離和跑步時間。結果提示:與 AlbCre-/Pcsk9LoxP/LoxP 小鼠與AlbCre +/Pcsk9LoxP/LoxP 小鼠在疲勞測試中觀察到的跑步距離和跑步時間 相似。
圖6C:顯示前肢抓地力測試。結果提示:AlbCre -/Pcsk9LoxP/LoxP 小鼠和 鼠骨骼肌機能相似。
圖6D和E:顯示收縮期左心室後壁厚度和射血分數。結果發現:AlbCre -/Pcsk9LoxP/LoxP 小鼠和 AlbCre +/Pcsk9LoxP/LoxP 小鼠收縮期左心室厚度(圖6D)、射血分數(圖6E)沒有明顯差異。
圖6F和G:顯示了心臟的ATP定量和能量電荷。
圖6H:為TCA的代謝物(檸檬酸,α-酮戊二酸,琥珀酰輔酶A,富馬酸,蘋果酸,草酰乙酸)變化。ATP產生(圖6F)、ATP能量電荷(圖6G)、三羧酸迴圈代謝物(圖6H)在這些小鼠的心臟中沒有差異。
圖6I:顯示了乳酸的血漿水平。與 AlbCre-/Pcsk9LoxP/LoxP 對照小鼠相比, AlbCre+/Pcsk9LoxP/LoxP 小鼠的迴圈乳酸水平未受響。綜上,肝臟產生(即迴圈)PCSK9缺乏對心臟功能無明顯影響,提示局部產生的PCSK9缺乏是心臟功能障礙的驅動因素。
遺傳性PCSK9功能喪失與人類心臟表型的改變有關
為了進一步轉化我們在人類中的發現,我們評估了PCSK9功能喪失變異(R46L)對來自普通人群的2606名受試者的基於心臟超音波的心臟功能標誌物的影響(PLIC研究)。對12名雜合R46L攜帶者的心臟特征進行初步分析(線上補充材料,表S2)顯示,與年齡和性別匹配的WT受試者相比,這些受試者的左心室品質指數顯著增加(圖7A),但射血分數相似(圖7B)。有趣的是,雜合子受試者和WT攜帶者的腿部和手臂骨骼肌品質相當(圖7C)。
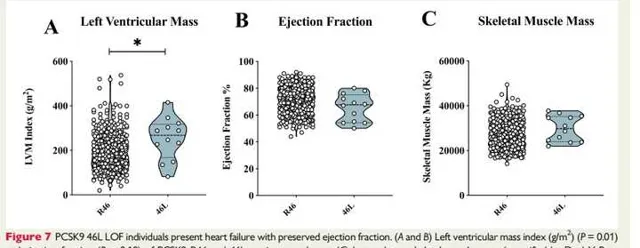
圖7:PCSK9 46L LOF個體出現射血分數保留的心力衰竭。
圖7A和B:顯示了PCSK9 R46和46L攜帶者的左心室品質指數(g/m²)和射血分數。結果提示:與年齡和性別匹配的WT受試者相比,這些受試者的左心室品質指數顯著增加(圖7A),但射血分數相似(圖7B)。
圖7C:顯示腿部和手臂骨骼肌品質(透過雙X射線吸收法量化,遵循漢森公式)。結果提示:雜合子受試者和WT攜帶者的腿部和手臂骨骼肌品質相當。
討論
在這項研究中,我們證明PCSK9在控制心臟代謝和功能方面起著關鍵作用。當PCSK9缺失時,參與脂質和脂蛋白攝取的關鍵受體的表達增加,導致心臟膽固醇積累、β-氧化和粒線體活性受損,從而影響心臟代謝和功能(圖文摘要)。
與肝臟不同,心臟不能合成大量FA,因此脂質需求主要透過從迴圈中攝取來滿足,但是需要適當控制以限制過量攝取(可能導致脂質累積和細胞脂毒性)。在這種情況下,心肌細胞將其代謝轉向無氧糖解作用,但這並不能完全補償增高的能量需求。
從生理上講,這種轉變會觸發心臟的一系列形態適應,包括增加左心室壁厚度以維持射血分數。這種特征是HFpEF的典型特征,其中心肌細胞將其代謝從FA氧化轉為粒線體,然後轉換為糖解作用和酮體利用,如高血壓和肥胖以及糖尿病患者中所描述的情況。
本研究表明在實驗模型的PCSK9缺陷條件下觀察到類似的特征。心臟代謝特征的詳細分析表明,耗氧率和ATP水平降低是粒線體功能受損的結果,同時ETC蛋白復合物和活性的改變也提示了這一點。
先前的觀察突出心臟脂質累積會導致脂毒性並促進心臟代謝轉換;因此,PCSK9缺乏導致心臟中膽固醇累積增加以及代謝轉向無氧糖解作用的觀察結果支持「PCSK9在維持與心肌細胞脂質攝取相關的因素適當平衡方面發揮生理作用」這一假設。
與這種活性明顯相關的候選因子就是脂蛋白受體。盡管與其他組織(如肝臟)相比,其在心臟中的表達程度較低,但仍在控制心臟脂蛋白攝取和脂質代謝方面發揮關鍵作用。LDL 和CD3這兩個PCSK9靶標的表達在Pcsk9 KO小鼠的心臟中增加可能代表了接受PCSK9抑制劑治療的患者關註的問題,因為LDLR再迴圈的增加是導致肝臟中脂蛋白攝取增加和血漿膽固醇降低的原因,但也可能影響心臟脂質累積。
為了進一步闡明這方面,在Pcsk9/Ldlr DKO小鼠和Ldlr KO小鼠中研究了心臟特征和跑步耐量。值得註意的是,Pcsk9/Ldlr DKO小鼠仍然存在心臟功能障礙和在Pcsk9 KO小鼠中觀察到的代謝後遺癥,而Ldlr KO與WT相比,收縮期的左心室品質/重量和心臟LVPW厚度顯著降低,因此排除了PCSK9觀察到的心臟表型中LDLR軸的作用。此外,這一發現表明,至少在心臟中,LDLR介導的脂蛋白攝取最終不會導致脂質累積和心臟代謝損傷。
PCSK9的藥理學抑制是否會導致心臟脂質攝取增加和心臟功能障礙嗎?來自PCSK9抑制劑的大型介入性試驗數據並未報告心力衰竭的發生率增加。
目前針對PCSK9的療法包括透過隔離迴圈PCSK9起作用的單複制抗體,以及透過選擇性沈默肝臟中PCSK9 mRNA表達的基因沈默方法。鑒於肝臟影響迴圈PCSK9水平,這兩種方法都會減少迴圈PCSK9,但不影響局部(除外肝臟)PCSK9的產生。
為了探索完全缺乏迴圈PCSK9是否會影響心臟代謝,在肝臟中PCSK9表達選擇性缺乏的實驗模型中評估了心臟功能:迴圈PCSK9水平低於檢測水平,但在其他組織中的表達未改變。這是一種模仿PCSK9抑制劑治療後觀察到的表型。
在這個實驗模型中,運動表現、心臟形態、代謝特征和耗氧量與WT小鼠均相似。這一觀察結果對於排除迴圈PCSK9缺乏對心臟代謝的影響具有開創性意義,並且與抗PCSK9療法臨床試驗中觀察到的心臟功能數據一致。
在基礎條件下,PCSK9在心臟中的表達水平非常低(線上補充材料,圖S71),但在缺血條件下(體內)和與氧化LDL孵育後(體外),其水平被誘導性升高。據推測,缺血/再灌註損傷後立即誘導PCSK9可能透過刺激自噬過程和去除受損粒線體來保護急性期的心臟,這種作用隨著時間的推移可能變得有害,可能導致細胞破壞和心肌細胞死亡增加。心外膜脂肪組織局部產生的PCSK9也有可能導致了這種病理生理變化,這一發現得到了R46L變異與人類心外膜脂肪累積增加相關的觀察結果的支持(與肥胖或糖尿病無關)。然而,我們沒有發現心外膜脂肪厚度與左心室品質之間存在任何相關性(數據未顯示),支持PCSK9對心外膜脂肪組織炎癥影響主要與射血分數降低的心力衰竭有關這一假說。
未來在更大的佇列中開展研究應該解決PCSK9功能喪失變異是否與心臟表型改變相關,而與在這些情況下觀察到的LDL-膽固醇水平的長期降低所導致的較低心血管風險無關。我們必須承認,在完整的Pcsk9 KO小鼠和肝臟選擇性PCSK9 KO模型中分析了心臟功能。雖然排除了迴圈PCSK9對觀察表型的作用,但應在心臟選擇性KO模型中對PCSK9心臟的選擇性作用進行最終確認。
同樣,Pcsk9/CD36 DKO的表征將有助於研究心臟應激後PCSK9的產生是否可能代表一種反饋機制,有助於維持心臟脂質攝取和脂質累積之間的適當平衡,從而限制心臟脂毒性的潛在副作用。










