近日,中國醫學科學院北京協和醫學院病原生物學研究所所崔勝、高小攀研究團隊和天津醫科大學宓文義團隊在Acta Pharmaceutica Sinica B雜誌線上發表了題為「SARS-CoV-2 ORF10 hijacking ubiquitination machinery reveals potential unique drug targeting sites」的論文。

病毒常常操縱泛素化途徑來促進其復制和致病性。由SARS-CoV-2感染引起的新冠肺炎癥狀包括咳嗽、發熱、肌肉疼痛、疲勞、味覺和嗅覺能力下降。先前的研究表明,SARS-CoV-2輔助蛋白ORF10透過與cullin-2(CUL2) RING E3連線酶受質受體CUL2ZYG11B交互作用,增加其E3連線酶活性,促進纖毛蛋白IFT46的降解,導致纖毛功能異常。然而,ORF10被CUL2ZYG11B辨識的分子機制尚不清楚。
本研究首先透過X射線晶體繞射技術解析了CUL2ZYG11B與SARS-CoV-2 ORF10 N端延伸部份(NTE)的復合物結構(2.9 Å),結構顯示ORF10 N端七肽(NTH)模擬Gly/N-降解子肽構象,結合到CUL2ZYG11B。基於結構的突變實驗驗證了ORF10的關鍵胺基酸殘基對其與CUL2ZYG11B在體外和細胞內的交互作用至關重要。隨後,本研究證明了ORF10介導的增強CUL2ZYG11B對IFT46降解活性與ORF10-CUL2ZYG11B之間的結合親和力相關。此外,透過Global Protein Stability system(GPS),本研究證明了ORF10模擬Gly/N-降解子,與CUL2ZYG11B競爭性結合並抑制攜帶Gly/N-降解子的目標受質的降解。
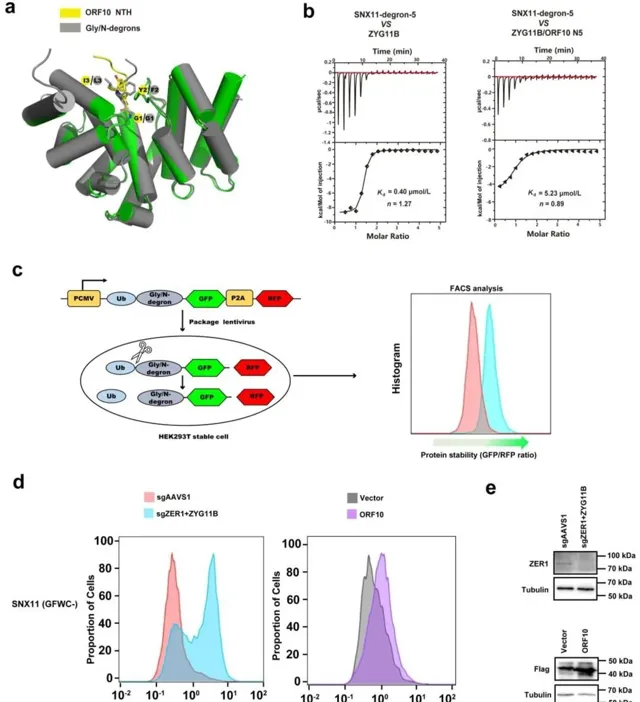
綜上所述,ORF10與CUL2ZYG11B之間的交互作用透過兩種不同的機制促進IFT46的降解並抑制攜帶Gly/N-降解子的CUL2ZYG11B靶標受質的降解:(1)透過非經典機制途徑,ORF10增加了CUL2ZYG11B活性,導致IFT46的降解;(2)透過經典機制途徑,ORF10的N端延伸(NTE)作為Gly/N-降解子的模擬物與CUL2ZYG11B結合,並競爭性抑制CUL2ZYG11B與其攜帶Gly/N-降解子的目標受質的結合。
這項研究揭示了SARS-CoV-2的ORF10如何利用泛素化機制進行蛋白酶體降解,並為基於ORF10 NTH肽與CUL2ZYG11B交互作用的PROTAC藥物設計最佳化提供了寶貴見解,同時為COVID-19的藥物研發提供了潛在藥物靶標。
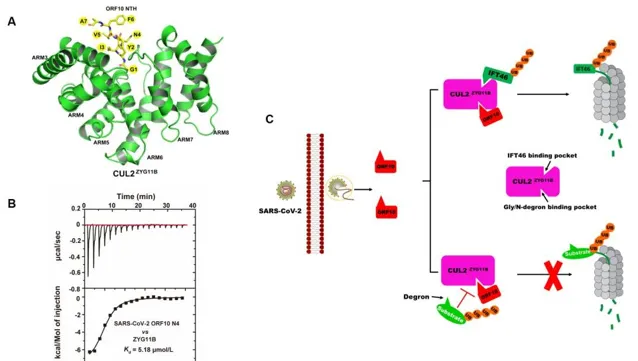
圖.SARS-CoV-2 ORF10與CUL2ZYG11B交互作用劫持泛素化的分子機制
本研究工作得到中國醫學科學院醫學與健康科技創新工程(2022-I2M-1-021)、國家自然科學基金(82341095,82272308)等計畫的資助。中國醫學科學院病原生物學研究所崔勝研究員,高小攀研究員和天津醫科大學基礎醫學院宓文義教授為論文共同通訊作者。協和青年學者朱凱祥博士,天津醫科大學基礎醫學院博士生宋莉莉,中國醫學科學院病原生物學研究所碩士生王臨嶽,中國醫學科學院病原生物學研究所與延安大學聯培碩士生花蕾為論文共同第一作者。











