
写在前面
今天推荐的是由瑞士苏黎世联邦理工学院化学和应用生物科学系在2019年9月17日发表于ACS Central Science(2021IF:18.7279,JCRQ1)的一篇文章,通讯作者是Erick M. Carreira教授,研究发现双稳态PhotoPROTAC对诱导蛋白质降解的可逆时空控制。
研究背景
组织外效应是现代抑制疗法的长期问题。通过合并光药学和小分子降解剂的策略,研究者引入了一个新的概念,对诱导的蛋白质降解进行持久的时空控制,这可能会防止组织外毒性。
摘要部分
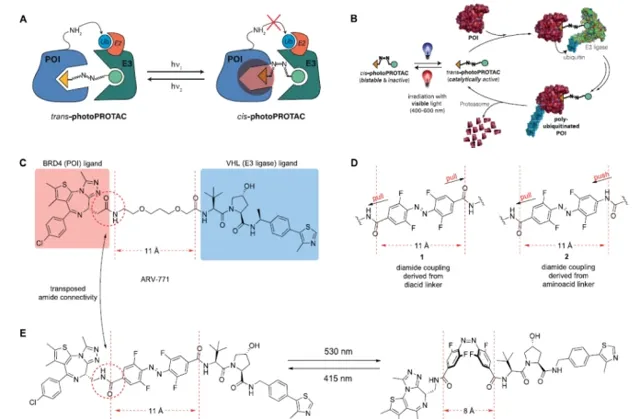
蛋白分解靶向嵌合体(PROTACs)的成功原理基础上,研究者通过在两个弹头配体之间加入正F4-偶氮苯连接体,设计了可光开关的PROTACs。这种高度双稳态而又可光转换的结构成分导致了对两个配体之间拓扑距离的可逆控制。观察到的偶氮异构体是不活跃的,因为由连接体定义的距离太短,不允许在蛋白质结合伙伴之间形成复合物。相比之下,偶氮反式异构体是有活性的,因为它可以使两个蛋白伙伴参与进来,形成必要的和有成效的三元复合体。重要的是,由于所采用的正-F4-偶氮苯的双稳态性质,PhotoPROTAC的光稳态是持久的,不需要连续照射。这种技术提供了可逆的蛋白质降解开关,与细胞内环境相适应,因此,在实验探索生物信号传导途径,如那些对致癌信号转导至关重要的途径时,可能很有用。此外,这种策略可能适用于治疗性干预,以解决各种疾病。通过实现蛋白质降解的可逆性激活和停用,PhotoPROTAC比传统的不可逆释放活性剂的光控策略更有优势。
研究内容

研究者设想产生光可转换的PROTACs,其中典型的线性聚醚连接剂被偶氮苯取代。这将有助于为PROTAC连接体引入一种新的光开关功能,而不是被动地将两个配体拴在一起。这个想法的核心是设计一个反式光敏PROTAC,它与优化的连接体长度相对应,可以有效地诱导感兴趣的蛋白质(POI)和E3连接酶之间形成三元复合物。作为一个PhotoPROTAC的概念验证,ARV-77113被选为生成光可转换BET蛋白降解剂的主导结构。为了在PROTAC支架中引入邻F4-偶氮苯片段,作为高度模块化合成方法的一部分,设想了两种不同的酰胺连接剂,涉及前体邻F4-偶氮苯二元酸,邻F4-偶氮苯氨基酸,如所示。将ARV-771中的低聚醚连接物替换为光敏连接物的设计提供了中所示的异构光敏PROTAC对,对于推定的活性反式光敏PROTAC-1来说,两个弹头之间保持了11A的最佳距离,而顺式光敏PROTAC-1的距离则缩小了8A。
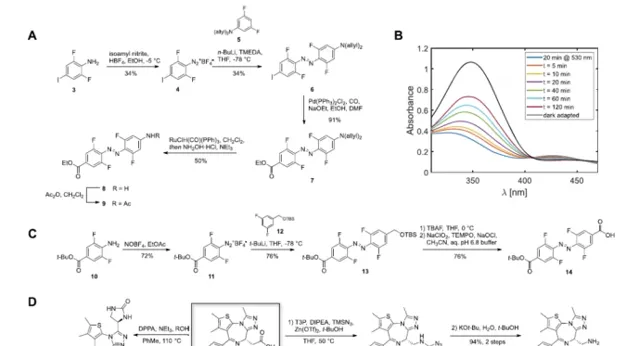
有了所有必要的构件,所需的BRDphotoPROTAC-1通过一系列的酰胺偶联被组装起来。在VHL配体与偶氮苯偶联后,用TFA水解叔丁基酯,并连接JQ-1胺18,得到邻F4偶氮苯连接的BRD-photoPROTAC-1。接下来,对生成的共轭物的光化学性质进行了检查。在DMSO中,通过415纳米的辐照有效地发生了顺反转换,产生了一种光稳定状态(PSS),包括95%的反式-PhotoPROTAC-1,通过HPLC分离这两种异构体来确定。在530纳米的照射下,建立了一个由68%顺式光稳定态(PSS)组成的PSS,与具有较高顺式PSS的邻F4-偶氮苯的例子相比,该PSS略有下降,尽管两种异构体的n.π*吸收最大值相差47纳米。
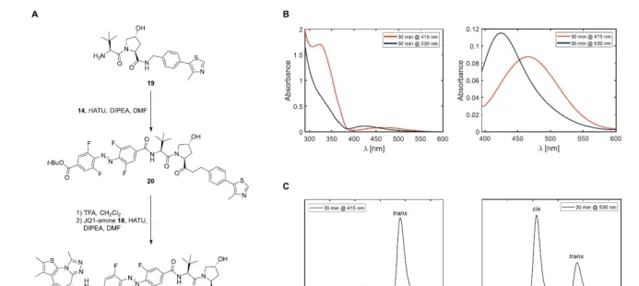
在确认了生物条件下的稳定性以及在530和415纳米照射下顺式和反式构型的有效切换后,研究者接下来在拉莫斯细胞中进行了生物实验。用415或530纳米的LED照射PhotoPROTAC-1溶液,最初照射20分钟,分别获得反式和顺式异构体;在休息1分钟和短暂涡旋后,继续照射10分钟。将反式和顺式PhotoPROTAC-1溶液稀释到所需的浓度并加入到Ramos细胞中。在低纳摩尔浓度的情况下,反式-PhotoPROTAC-1孵化6.5小时可明显诱导BRD2的降解。相反,顺式PhotoPROTAC-1在测试的浓度范围内没有诱导BRD2的降解。与顺式或反式光敏剂PROTAC-1孵育18小时后,没有改善或影响BRD2的降解效率。有趣的是,在没有最初的415纳米辐照的情况下,PhotoPROTAC-1没有诱导细胞有效地降解BRD2,表明反式和顺式PhotoPROTAC-1的混合物的存在导致BRD2降解的减少。对这一现象的一个可能的解释是,无活性的顺式异构体对BRD2或VHL的亲和力高于转基因PROTAC-1,它阻止活性异构体的结合,从而防止诱导降解。因此,远低于530纳米处68%顺式的PSS比率显然足以防止降解。
为了研究反式和顺式PhotoPROTAC-1的时间依赖性降解情况,在1到24小时的不同时间点收获了Ramos细胞。然而,在孵化3小时后,反式PhotoPROTAC-1诱导BRD2降解,并在接下来的4小时内增加。7小时后,BRD2降解达到最高水平,并在接下来的17小时内保持不变。为了证实反式光合剂通过蛋白酶体途径诱导BRD2降解,研究者分析了在选择性NEDD8抑制剂MLN-4924存在或不存在的情况下BRD2降解的情况。用MLN-4924处理可以抑制BRD2的降解,表明BRD2的降解是通过蛋白体途径进行的。此外,在与反式PhotoPROTAC-1培养18小时后,BRD2持续降解,以及在与顺式PhotoPROTAC-1培养18小时后,BRD2降解持续暂停),表明含有o-F4-偶氮苯的PhotoPROTAC-1的双态性。如果活跃的反式异构体在实验过程中转换为不活跃的顺式异构体,考虑到BRD蛋白作为一种反馈机制在抑制作用下发生的大量再合成,持续的BRD2降解将不会很突出。反之亦然,如果顺式异构体在实验的时间范围内转换为热力学上更稳定的活性反式异构体,BRD2的降解就会随着时间的推移而被诱导。因此,研究者的方法提供了对诱导降解的有力控制。
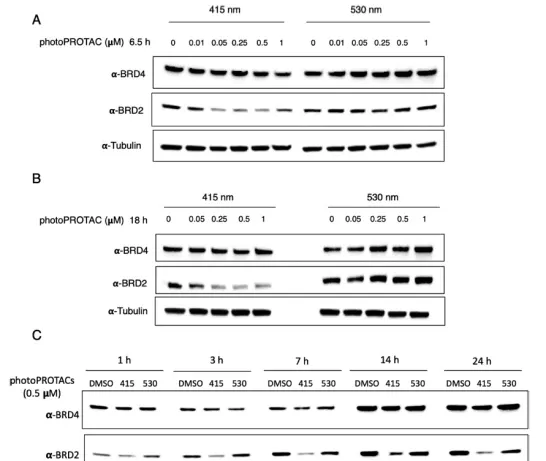
用不同辐照组合得到的photoPROTAC-1培养18小时后,裂解细胞并分析BRD4和BRD2的水平。与之前的实验一致,通过单次辐照获得的反式光普罗旺斯-1和顺式光普罗旺斯-1观察到类似的BRD4/2降解模式。关于双重辐照的photoPROTAC-1,数据显示在第二次辐照后其降解潜力完全逆转,表明photoPROTAC在活性和非活性状态之间的动态切换。为了进一步研究photoPROTAC-1的可逆性和时间可控性,一组用反式photoPROTAC-1处理的细胞在黑暗中培养,另一组平行的细胞(反式photoPROTAC-1处理)在530纳米照射下培养。正如预期的那样,在所需的时间点对细胞进行530纳米的光照,顺式PROTAC-1就被回收了。细胞内的转化被证实,与保持在黑暗中的细胞的BRD2水平相比,BRD2降解停止。此外,当顺式photoPROTAC-1处理的细胞在415纳米的LED下培养时,观察到明显的BRD2降解,这表明邻F4-偶氮苯分子可以成功地纳入PROTAC连接物中,以可逆的方式对目标蛋白降解进行光诱导、时空控制。

结论与讨论
最近在药物发现方面的两个新兴领域,即光药学和小分子降解剂的结合,促使研究者提出了光开关、双稳态PhotoPROTAC的概念,对多方面的应用有潜在的深远影响。与现代蛋白质组学的方法相结合,PhotoPROTAC为研究尚未充分了解的信号通路的下游效应提供了进一步的机会。通过一次辐照事件对PhotoPROTAC的时空激活/停用可能在新型疗法中具有很大的应用前景。
Thank you!











