一提到诺贝尔奖,无人不知无人不晓,其中诺贝尔化学奖更是被网友称为诺贝尔理综奖,因为近十年颁发的诺贝尔化学奖集结了理化生三科。然而,2021年,本亚明·利斯特(Benjamin List)和大卫·麦克米兰(David W.C. MacMillan)的研究将诺贝尔化学奖重新聚焦于纯化学领域,推动有机小分子催化剂的发展,继金属和酶之后。

从大卫·麦克米兰课题组的官方主页上可以明显看到,光氧化还原催化的地位超越了有机催化,引起了广泛关注。许多化学从业者,包括绝大多数麦克米兰组的毕业生,一致认为他在有机光氧化还原催化方面的贡献更为显著。麦克米兰不仅创造了光氧化还原催化的概念,而且通过开创性工作证明了利用光氧化还原催化可实现高选择性、温和生成自由基中间体的技术,对自由基化学领域产生了革命性影响。因此,许多化学科研者坚信他未来有望因光氧化还原催化再次获得诺贝尔奖。
值得一提的是,麦克米兰除了在科研领域取得惊人成就外,其独特的人格魅力和传奇的人生经历也成为人们津津乐道的焦点。

苏格兰出生的麦克米兰,家境普通,父亲是钢铁工人,母亲是家庭帮手。他的化学之路可谓歪打正着:18岁时考入格拉斯哥大学物理专业,然而,冷气过足的物理系楼让他冻得够呛。而抠门的化学系虽然没钱开冷气,但相对暖和,于是他毅然转投化学系。在麦克米伦看来,作为一名化学家最大的乐趣就是得到一个完全不同的结果。

麦克米兰所领导的课题组也是风趣横生,他认为不让学生开心的老板不是好老板。考虑到许多化学专业的学生已经很难赚到钱了,再不开心点就更惨了。在普林斯顿大学,麦克米伦的实验室或许不是最高产的,但绝对是最喜欢团建的。聚众喝酒、烧烤、开party一样都没落下!麦克米伦虽然和学生们相爱相杀,但像每个老父亲一样,他默默守护着学生们的幸福。他希望他的学生去做他们想做的事,而不是别人让他们去做的事。
不要以为麦克米兰课题组得了诺贝尔奖后,就躺平了!优秀的人把优秀当成了一种习惯!2024年,不到半年,麦克米兰课题组已经连发4篇NS。


加点铁,就能解锁卡宾反应性
一些重要的中间体,如碳离子、碳阳离子、自由基和卡宾,是许多关键化学键形成的重要因素。获得这些中间体需要具有高能基态的活性起始材料,这限制了官能团的相容性,特别是在合成具有复杂结构的目标分子时。有机化学的进步使一些合成上有重要作用的高能物质得以可控获得。光氧化还原催化利用可见光进行反应性上转换,将稳定的起始物质转化为活性自由基。金属光氧化还原催化可以将过渡金属交叉偶联与这些自由基中间体结合在一起,为有机催化的进步提供了巨大的可能性。相比之下,尽管卡宾和类卡宾在化学键形成中具有类似的能力,但它们的广泛获取仍然存在极大的挑战性。传统的用于获取这些碳中间体的方法主要依赖于高能或双官能前体,如重氮化合物、多卤化前体或磺酰化合物等。但这些起始材料的反应性和结构特异性限制了其实用性,并且在某些情况下引起了安全问题,例如需要高温或爆炸性试剂。
为此,来自美国普林斯顿大学David W. C. MacMillan教授团队报道了一种可见光介导的策略,通过自由基加成和还原诱导的α-消除序列,在六种不同类型的非传统离去基上操作,从而实现了从丰富的前体中获取铁卡宾。该工作以题为「Unlocking carbene reactivity by metallaphotoredox α-elimination」发表在【Nature】上。

【探索碳中间体的自由基法】
作者最开始选择了α-乙酰氧基羧酸,因为羧酸容易形成自由基。选择铁卟啉作为金属支架来评估自由基结合和α-消除。铁表现出与烷基自由基的金属化反应性。此外,在适当的氧化状态下,铁可以很容易地促进α-消除,并且这种状态可以用光催化剂来控制。选择环丙烷化反应作为模型反应,目的是由于所产生的环丙烷产品对工业界和学术界具有较高的价值。可以观察到,在蓝光照射下,以二乙基-1,4-二氢-2,6-二甲基-3,5-吡啶二羧酸酯(Hantzsch酯)作为牺牲还原剂,以及催化量的氯化5,10,15,20-四(4-甲氧基苯基)-21H, 23H-卟啉铁(III)(Fe(TMPP)Cl)和Ir(dFCF 3ppy) 2dttbpyPF 6,可以将乙酸保护的乳酸成功地对2-(丙级-1-烯-2-炔基)萘进行环丙烷化。这证明了该反应策略的可行性。经过进一步的反应条件优化,得到所需的环丙烷化产物,收率为95%。对照实验揭示了所有反应组分的必要性,在没有铁催化剂、光或Hantzsch酯的情况下,没有产物形成。在没有铱光催化剂的情况下,观察到效率降低(36%),这与Hantzsch酯介导的电子供体-受体络合物自由基生成相一致。这些初步实验支持了新型金属光氧化还原介导的二氧化碳生成和捕获范式的可行性。
在确定了环丙烷化过程的可行性之后,在最佳条件下,作者探索了为铁卡宾形成而离去基团的适用范围。作者合成了具有一系列非传统α-氧基的乳酸衍生物NHPI酯:α-苯氧基、α-甲氧基和α-羟基。在α-乙酰氧基体系的优化条件下,这些底物均能有效地进行环丙化反应(收率为77 ~ 95%)。这种耐受性使作者开始探索非氧基离去基团的可能性。利用净还原反应条件研究了α-氨基酸作为铁卡宾的前体。利用一系列胺保护基团,系统地评估了α-消除步骤。虽然大多数保护基团是无效的,但可以观察到甲酰和三酰保护的α-氨基酸可以以良好的产率提供所需的环丙烷化产物。延伸到甲酰基和三甲基胺的离去基是氮基离去基参与取代/消除型反应性的一个罕见的例子,也是一个未被充分探索的脱胺官能化策略。反应的发展可以鉴定出六种不同的能作为卡宾前体的离去基,证明了铁卟啉α-消除对广泛的离去基能力的耐受性,并提供了一个模块化的策略来获得卡宾中间体。

图1. 金属卡宾形成示意图
【含铁羰基中间体环丙烷化范围】
在优化环丙烷化条件后,作者探索了羧酸和烯烃的适用范围。由α-乙酰羧酸生成的苄基和烷基羰基都是有效的偶联伙伴。苯乙烯(1)和富电子烯烃(2-4)可以顺利进行环丙烷化反应。氨基甲酸苄酯(CBz)保护的脱氢丙氨酸以中等产率环丙化(5),代表了一种温和而简便的肽骨架修饰方法。具有一系列官能团的复杂分子骨架也被发现可以进行有效的金属光氧化还原环丙烷化,证明了这种方法对复杂分子后功能化的适用性(6-8)。此外,叔胺在光氧化还原条件下由于竞争性氧化而存在问题,但在改进方案下,包括加入三羧酸来使胺质子化,可以使叔胺的耐受性大幅度提高(7)。对α-甲氧基和α-苯氧基羧酸范围的探索表明,一系列取代的羰基和烯烃在反应条件下表现良好。尽管反应性和产率降低,但仍有几种氨基酸形成了卡宾,受苯甲基保护的丙氨酸、蛋氨酸亚砜、亮氨酸和赖氨酸是可行的卡宾前体。

图2. 条件优化及反应适用性

图3. 反应适用性
【羧酸衍生物作为卡宾前体】
考虑到自由基与金属中心的结合与自由基的产生是分开的步骤,作者想知道这种模式是否可以扩展到羧酸衍生的其他自由基前体。在生产高价值的氟烷基环丙烷的过程中,作者将注意力转向了获取氟烷基卡宾。由于其代谢稳定性和对药代动力学和药效学谱的有益影响,氟甲基化环丙烷已成为药物中有重要意义的步骤。尽管人们其兴趣越来越大,但氟甲基化环丙烷的获取具有非常大的挑战性,因为它们目前必须通过重氮物质合成,这带来了重大的安全问题。使用易获取的2,2,2-三氟乙基化NHPI醚,在使用苯乙烯衍生物时,包括无保护的吲哚(29)和羧酸(30),环丙烷化过程可以顺利进行,表现出了对酸性官能团的耐受性。在酸化策略下,游离胺是耐受的(31)。含α-酯官能团的缺电子苯乙烯以适中的产率进行了环丙烷化反应(32),二烯成功地转化为烯丙基三氟甲基化环丙烷(33)。由尿嘧啶衍生的烯酰胺只与更富电子的烯烃反应(34),与亲电的铁卟啉羰基反应性一致。苯胺和cbz保护的胺在反应中耐受性良好,产生氨基环丙烷产物(35-37)。少见的环丙烷,如羟基环丙烷类似物,也可通过苯甲酸乙烯基获得(38)。药物化合物和复杂的药物分子骨架同样被证明可以以高产量环丙化,表明该方法具有高官能团耐受性,并具有应用于后功能化的潜力(39-46)。使用2,2-二氟乙醇作为起始原料证明同样有效,以中等产量得到了二氟甲基取代环丙烷(47-51)。
【σ-键插入反应】
除环丙烷化反应外,铁卡宾由于其Fischer型卡宾的性质,还会发生σ-键插入反应。这种反应性为利用金属光氧化还原产生的瞬态卡宾提供了另一种潜在途径。实验上,可以观察到β-氟醇和羧酸基系统成功插入P-H键。将这种反应性扩展到硫酚原料,可以合成(二氟)烷基化硫醚产品(54和55)。此外,苯胺和胺的N-H烷基化也可以被插入,包括在含有重要医药价值的缺电子杂芳烃的骨架上(56-59)也可以顺利进行插入反应。通过与NHPI活化的α-苯氧丙烷酸反应,可以得到单烷基化胺产品,绕过了传统的酰胺键形成反应(60)。
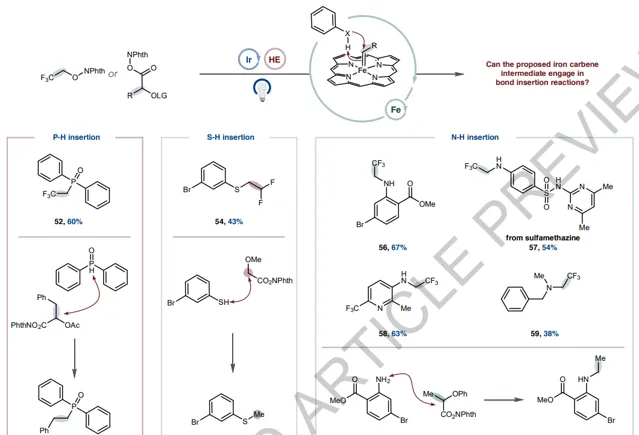
图4. σ-键插入反应
总结,该研究展示了一种新颖的金属光氧化还原策略,用于形成卡宾中间体,通过辐射加成和氧化还原反应生成所需的金属卡宾中间体,扩展了传统卡宾形成方法的范围,实现了环丙烷化和X-H插入反应。这一方法克服了传统方法的局限性,具有广泛的应用前景。
声明:仅代表作者个人观点,作者水平有限,如有不科学之处,请在下方留言指正!











