
寫在前面
今天推薦的是由瑞士蘇黎世聯邦理工學院化學和套用生物科學系在2019年9月17日發表於ACS Central Science(2021IF:18.7279,JCRQ1)的一篇文章,通訊作者是Erick M. Carreira教授,研究發現雙穩態PhotoPROTAC對誘導蛋白質降解的可逆時空控制。
研究背景
組織外效應是現代抑制療法的長期問題。透過合並光藥學和小分子降解劑的策略,研究者引入了一個新的概念,對誘導的蛋白質降解進行持久的時空控制,這可能會防止組織外毒性。
摘要部份
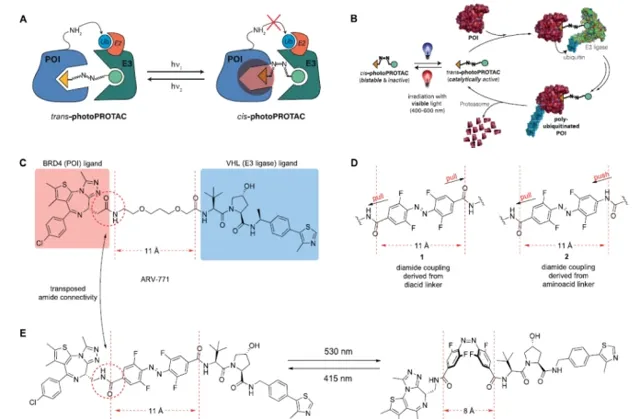
蛋白分解靶向嵌合體(PROTACs)的成功原理基礎上,研究者透過在兩個彈頭配體之間加入正F4-偶氮苯連線體,設計了可光開關的PROTACs。這種高度雙穩態而又可光轉換的結構成分導致了對兩個配體之間拓撲距離的可逆控制。觀察到的偶氮異構體是不活躍的,因為由連線體定義的距離太短,不允許在蛋白質結合夥伴之間形成復合物。相比之下,偶氮反式異構體是有活性的,因為它可以使兩個蛋白夥伴參與進來,形成必要的和有成效的三元復合體。重要的是,由於所采用的正-F4-偶氮苯的雙穩態性質,PhotoPROTAC的光穩態是持久的,不需要連續照射。這種技術提供了可逆的蛋白質降解開關,與細胞內環境相適應,因此,在實驗探索生物訊號傳導途徑,如那些對致癌訊息傳遞至關重要的途徑時,可能很有用。此外,這種策略可能適用於治療性幹預,以解決各種疾病。透過實作蛋白質降解的可逆性啟用和停用,PhotoPROTAC比傳統的不可逆釋放活性劑的光控策略更有優勢。
研究內容

研究者設想產生光可轉換的PROTACs,其中典型的線性聚醚連線劑被偶氮苯取代。這將有助於為PROTAC連線體引入一種新的光開關功能,而不是被動地將兩個配體拴在一起。這個想法的核心是設計一個反式光敏PROTAC,它與最佳化的連線體長度相對應,可以有效地誘導感興趣的蛋白質(POI)和E3連線酶之間形成三元復合物。作為一個PhotoPROTAC的概念驗證,ARV-77113被選為生成光可轉換BET蛋白降解劑的主導結構。為了在PROTAC支架中引入鄰F4-偶氮苯片段,作為高度模組化合成方法的一部份,設想了兩種不同的醯胺連線劑,涉及前體鄰F4-偶氮苯二元酸,鄰F4-偶氮苯胺基酸,如所示。將ARV-771中的低聚醚連線物替換為光敏連線物的設計提供了中所示的異構光敏PROTAC對,對於推定的活性反式光敏PROTAC-1來說,兩個彈頭之間保持了11A的最佳距離,而順式光敏PROTAC-1的距離則縮小了8A。
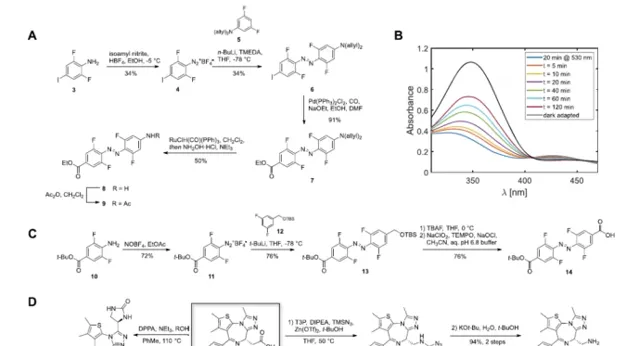
有了所有必要的構件,所需的BRDphotoPROTAC-1透過一系列的醯胺偶聯被組裝起來。在VHL配體與偶氮苯偶聯後,用TFA水解叔丁基酯,並連線JQ-1胺18,得到鄰F4偶氮苯連線的BRD-photoPROTAC-1。接下來,對生成的共軛物的光化學性質進行了檢查。在DMSO中,透過415納米的輻照有效地發生了順反轉換,產生了一種光穩定狀態(PSS),包括95%的反式-PhotoPROTAC-1,透過HPLC分離這兩種異構體來確定。在530納米的照射下,建立了一個由68%順式光穩定態(PSS)組成的PSS,與具有較高順式PSS的鄰F4-偶氮苯的例子相比,該PSS略有下降,盡管兩種異構體的n.π*吸收最大值相差47納米。
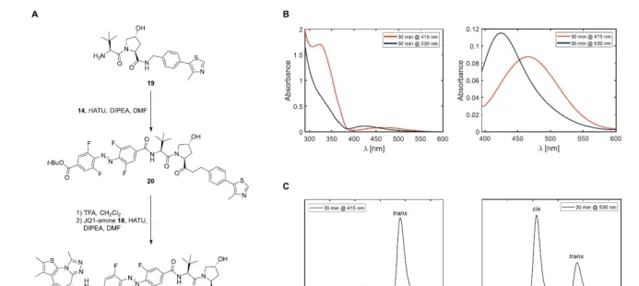
在確認了生物條件下的穩定性以及在530和415納米照射下順式和反式構型的有效切換後,研究者接下來在拉莫斯細胞中進行了生物實驗。用415或530納米的LED照射PhotoPROTAC-1溶液,最初照射20分鐘,分別獲得反式和順式異構體;在休息1分鐘和短暫渦旋後,繼續照射10分鐘。將反式和順式PhotoPROTAC-1溶液稀釋到所需的濃度並加入到Ramos細胞中。在低納摩爾濃度的情況下,反式-PhotoPROTAC-1孵化6.5小時可明顯誘導BRD2的降解。相反,順式PhotoPROTAC-1在測試的濃度範圍內沒有誘導BRD2的降解。與順式或反式光敏劑PROTAC-1孵育18小時後,沒有改善或影響BRD2的降解效率。有趣的是,在沒有最初的415納米輻照的情況下,PhotoPROTAC-1沒有誘導細胞有效地降解BRD2,表明反式和順式PhotoPROTAC-1的混合物的存在導致BRD2降解的減少。對這一現象的一個可能的解釋是,無活性的順式異構體對BRD2或VHL的親和力高於轉基因PROTAC-1,它阻止活性異構體的結合,從而防止誘導降解。因此,遠低於530納米處68%順式的PSS比率顯然足以防止降解。
為了研究反式和順式PhotoPROTAC-1的時間依賴性降解情況,在1到24小時的不同時間點收獲了Ramos細胞。然而,在孵化3小時後,反式PhotoPROTAC-1誘導BRD2降解,並在接下來的4小時內增加。7小時後,BRD2降解達到最高水平,並在接下來的17小時內保持不變。為了證實反式光合劑透過蛋白酶體途徑誘導BRD2降解,研究者分析了在選擇性NEDD8抑制劑MLN-4924存在或不存在的情況下BRD2降解的情況。用MLN-4924處理可以抑制BRD2的降解,表明BRD2的降解是透過蛋白體途徑進行的。此外,在與反式PhotoPROTAC-1培養18小時後,BRD2持續降解,以及在與順式PhotoPROTAC-1培養18小時後,BRD2降解持續暫停),表明含有o-F4-偶氮苯的PhotoPROTAC-1的雙態性。如果活躍的反式異構體在實驗過程中轉換為不活躍的順式異構體,考慮到BRD蛋白作為一種反饋機制在抑制作用下發生的大量再合成,持續的BRD2降解將不會很突出。反之亦然,如果順式異構體在實驗的時間範圍內轉換為熱力學上更穩定的活性反式異構體,BRD2的降解就會隨著時間的推移而被誘導。因此,研究者的方法提供了對誘導降解的有力控制。
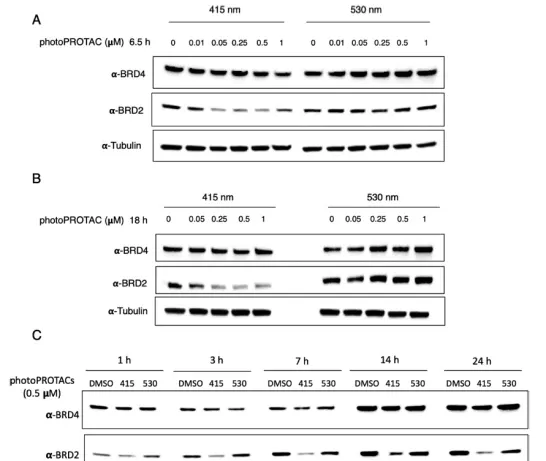
用不同輻照組合得到的photoPROTAC-1培養18小時後,裂解細胞並分析BRD4和BRD2的水平。與之前的實驗一致,透過單次輻照獲得的反式光普羅旺斯-1和順式光普羅旺斯-1觀察到類似的BRD4/2降解模式。關於雙重輻照的photoPROTAC-1,數據顯示在第二次輻照後其降解潛力完全逆轉,表明photoPROTAC在活性和非活性狀態之間的動態切換。為了進一步研究photoPROTAC-1的可逆性和時間可控性,一組用反式photoPROTAC-1處理的細胞在黑暗中培養,另一組平行的細胞(反式photoPROTAC-1處理)在530納米照射下培養。正如預期的那樣,在所需的時間點對細胞進行530納米的光照,順式PROTAC-1就被回收了。細胞內的轉化被證實,與保持在黑暗中的細胞的BRD2水平相比,BRD2降解停止。此外,當順式photoPROTAC-1處理的細胞在415納米的LED下培養時,觀察到明顯的BRD2降解,這表明鄰F4-偶氮苯分子可以成功地納入PROTAC連線物中,以可逆的方式對目標蛋白降解進行光誘導、時空控制。

結論與討論
最近在藥物發現方面的兩個新興領域,即光藥學和小分子降解劑的結合,促使研究者提出了光開關、雙穩態PhotoPROTAC的概念,對多方面的套用有潛在的深遠影響。與現代蛋白質組學的方法相結合,PhotoPROTAC為研究尚未充分了解的訊號通路的下遊效應提供了進一步的機會。透過一次輻照事件對PhotoPROTAC的時空啟用/停用可能在新型療法中具有很大的套用前景。
Thank you!











