一提到諾貝爾獎,無人不知無人不曉,其中諾貝爾化學獎更是被網友稱為諾貝爾理綜獎,因為近十年頒發的諾貝爾化學獎集結了理化生三科。然而,2021年,本亞明·利斯特(Benjamin List)和大衛·麥克米蘭(David W.C. MacMillan)的研究將諾貝爾化學獎重新聚焦於純化學領域,推動有機小分子催化劑的發展,繼金屬和酶之後。

從大衛·麥克米蘭課題組的官方主頁上可以明顯看到,光氧化還原催化的地位超越了有機催化,引起了廣泛關註。許多化學從業者,包括絕大多數麥克米蘭組的畢業生,一致認為他在有機光氧化還原催化方面的貢獻更為顯著。麥克米蘭不僅創造了光氧化還原催化的概念,而且透過開創性工作證明了利用光氧化還原催化可實作高選擇性、溫和生成自由基中間體的技術,對自由基化學領域產生了革命性影響。因此,許多化學科研者堅信他未來有望因光氧化還原催化再次獲得諾貝爾獎。
值得一提的是,麥克米蘭除了在科研領域取得驚人成就外,其獨特的人格魅力和傳奇的人生經歷也成為人們津津樂道的焦點。

蘇格蘭出生的麥克米蘭,家境普通,父親是鋼鐵工人,母親是家庭幫手。他的化學之路可謂歪打正著:18歲時考入格拉斯哥大學物理專業,然而,冷氣過足的物理系樓讓他凍得夠嗆。而摳門的化學系雖然沒錢開冷氣,但相對暖和,於是他毅然轉投化學系。在麥克米倫看來,作為一名化學家最大的樂趣就是得到一個完全不同的結果。

麥克米蘭所領導的課題組也是風趣橫生,他認為不讓學生開心的老板不是好老板。考慮到許多化學專業的學生已經很難賺到錢了,再不開心點就更慘了。在普林斯頓大學,麥克米倫的實驗室或許不是最高產的,但絕對是最喜歡團建的。聚眾喝酒、燒烤、開party一樣都沒落下!麥克米倫雖然和學生們相愛相殺,但像每個老父親一樣,他默默守護著學生們的幸福。他希望他的學生去做他們想做的事,而不是別人讓他們去做的事。
不要以為麥克米蘭課題組得了諾貝爾獎後,就躺平了!優秀的人把優秀當成了一種習慣!2024年,不到半年,麥克米蘭課題組已經連發4篇NS。


加點鐵,就能解鎖碳烯反應性
一些重要的中間體,如碳離子、碳陽離子、自由基和碳烯,是許多關鍵化學鍵形成的重要因素。獲得這些中間體需要具有高能基態的活性起始材料,這限制了官能團的相容性,特別是在合成具有復雜結構的目標分子時。有機化學的進步使一些合成上有重要作用的高能物質得以可控獲得。光氧化還原催化利用可見光進行反應性上轉換,將穩定的起始物質轉化為活性自由基。金屬光氧化還原催化可以將過渡金屬交叉偶聯與這些自由基中間體結合在一起,為有機催化的進步提供了巨大的可能性。相比之下,盡管碳烯和類碳烯在化學鍵形成中具有類似的能力,但它們的廣泛獲取仍然存在極大的挑戰性。傳統的用於獲取這些碳中間體的方法主要依賴於高能或雙官能前體,如重氮化合物、多鹵化前體或磺酰化合物等。但這些起始材料的反應性和結構特異性限制了其實用性,並且在某些情況下引起了安全問題,例如需要高溫或爆炸性試劑。
為此,來自美國普林斯頓大學David W. C. MacMillan教授團隊報道了一種可見光介導的策略,透過自由基加成和還原誘導的α-消除序列,在六種不同類別的非傳統離去基上操作,從而實作了從豐富的前體中獲取鐵碳烯。該工作以題為「Unlocking carbene reactivity by metallaphotoredox α-elimination」發表在【Nature】上。

【探索碳中間體的自由基法】
作者最開始選擇了α-乙酰氧基羧酸,因為羧酸容易形成自由基。選擇鐵紫質作為金屬支架來評估自由基結合和α-消除。鐵表現出與烷基自由基的金屬化反應性。此外,在適當的氧化狀態下,鐵可以很容易地促進α-消除,並且這種狀態可以用光催化劑來控制。選擇環丙烷化反應作為模型反應,目的是由於所產生的環丙烷產品對工業界和學術界具有較高的價值。可以觀察到,在藍光照射下,以二乙基-1,4-二氫-2,6-二甲基-3,5-吡啶二羧酸酯(Hantzsch酯)作為犧牲還原劑,以及催化量的氯化5,10,15,20-四(4-甲氧基苯基)-21H, 23H-紫質鐵(III)(Fe(TMPP)Cl)和Ir(dFCF 3ppy) 2dttbpyPF 6,可以將乙酸保護的乳酸成功地對2-(丙級-1-烯-2-炔基)萘進行環丙烷化。這證明了該反應策略的可行性。經過進一步的反應條件最佳化,得到所需的環丙烷化產物,收率為95%。對照實驗揭示了所有反應組分的必要性,在沒有鐵催化劑、光或Hantzsch酯的情況下,沒有產物形成。在沒有銥光催化劑的情況下,觀察到效率降低(36%),這與Hantzsch酯介導的電子供體-受體絡合物自由基生成相一致。這些初步實驗支持了新型金屬光氧化還原介導的二氧化碳生成和捕獲範式的可行性。
在確定了環丙烷化過程的可行性之後,在最佳條件下,作者探索了為鐵碳烯形成而離去基團的適用範圍。作者合成了具有一系列非傳統α-氧基的乳酸衍生物NHPI酯:α-苯氧基、α-甲氧基和α-羥基。在α-乙酰氧基體系的最佳化條件下,這些受質均能有效地進行環丙化反應(收率為77 ~ 95%)。這種耐受性使作者開始探索非氧基離去基團的可能性。利用凈還原反應條件研究了α-胺基酸作為鐵碳烯的前體。利用一系列胺保護基團,系統地評估了α-消除步驟。雖然大多數保護基團是無效的,但可以觀察到甲酰和三酰保護的α-胺基酸可以以良好的產率提供所需的環丙烷化產物。延伸到甲酰基和三甲基胺的離去基是氮基離去基參與取代/消除型反應性的一個罕見的例子,也是一個未被充分探索的脫胺官能化策略。反應的發展可以鑒定出六種不同的能作為碳烯前體的離去基,證明了鐵紫質α-消除對廣泛的離去基能力的耐受性,並提供了一個模組化的策略來獲得碳烯中間體。

圖1. 金屬碳烯形成示意圖
【含鐵羰基中間體環丙烷化範圍】
在最佳化環丙烷化條件後,作者探索了羧酸和烯烴的適用範圍。由α-乙酰羧酸生成的芐基和烷基羰基都是有效的偶聯夥伴。苯乙烯(1)和富電子烯烴(2-4)可以順利進行環丙烷化反應。胺基甲酸芐酯(CBz)保護的去氫丙胺酸以中等產率環丙化(5),代表了一種溫和而簡便的肽骨架修飾方法。具有一系列官能團的復雜分子骨架也被發現可以進行有效的金屬光氧化還原環丙烷化,證明了這種方法對復雜分子後功能化的適用性(6-8)。此外,叔胺在光氧化還原條件下由於競爭性氧化而存在問題,但在改進方案下,包括加入三羧酸來使胺質子化,可以使叔胺的耐受性大振幅提高(7)。對α-甲氧基和α-苯氧基羧酸範圍的探索表明,一系列取代的羰基和烯烴在反應條件下表現良好。盡管反應性和產率降低,但仍有幾種胺基酸形成了碳烯,受苯甲基保護的丙胺酸、蛋胺酸亞碸、白胺酸和賴胺酸是可行的碳烯前體。

圖2. 條件最佳化及反應適用性

圖3. 反應適用性
【羧酸衍生物作為碳烯前體】
考慮到自由基與金屬中心的結合與自由基的產生是分開的步驟,作者想知道這種模式是否可以擴充套件到羧酸衍生的其他自由基前體。在生產高價值的氟烷基環丙烷的過程中,作者將註意力轉向了獲取氟烷基碳烯。由於其代謝穩定性和對藥代動力學和藥效學譜的有益影響,氟甲基化環丙烷已成為藥物中有重要意義的步驟。盡管人們其興趣越來越大,但氟甲基化環丙烷的獲取具有非常大的挑戰性,因為它們目前必須透過重氮物質合成,這帶來了重大的安全問題。使用易獲取的2,2,2-三氟乙基化NHPI醚,在使用苯乙烯衍生物時,包括無保護的吲哚(29)和羧酸(30),環丙烷化過程可以順利進行,表現出了對酸性官能團的耐受性。在酸化策略下,遊離胺是耐受的(31)。含α-酯官能團的缺電子苯乙烯以適中的產率進行了環丙烷化反應(32),二烯成功地轉化為烯丙基三氟甲基化環丙烷(33)。由尿嘧啶衍生的烯醯胺只與更富電子的烯烴反應(34),與親電的鐵紫質羰基反應性一致。苯胺和cbz保護的胺在反應中耐受性良好,產生胺基環丙烷產物(35-37)。少見的環丙烷,如羥基環丙烷類似物,也可透過苯甲酸乙烯基獲得(38)。藥物化合物和復雜的藥物分子骨架同樣被證明可以以高產量環丙化,表明該方法具有高官能團耐受性,並具有套用於後功能化的潛力(39-46)。使用2,2-二氟乙醇作為起始原料證明同樣有效,以中等產量得到了二氟甲基取代環丙烷(47-51)。
【σ-鍵插入反應】
除環丙烷化反應外,鐵碳烯由於其Fischer型碳烯的性質,還會發生σ-鍵插入反應。這種反應性為利用金屬光氧化還原產生的瞬態碳烯提供了另一種潛在途徑。實驗上,可以觀察到β-氟醇和羧酸基系統成功插入P-H鍵。將這種反應性擴充套件到硫酚原料,可以合成(二氟)烷基化硫醚產品(54和55)。此外,苯胺和胺的N-H烷基化也可以被插入,包括在含有重要醫藥價值的缺電子雜芳烴的骨架上(56-59)也可以順利進行插入反應。透過與NHPI活化的α-苯氧丙烷酸反應,可以得到單烷基化胺產品,繞過了傳統的醯胺鍵形成反應(60)。
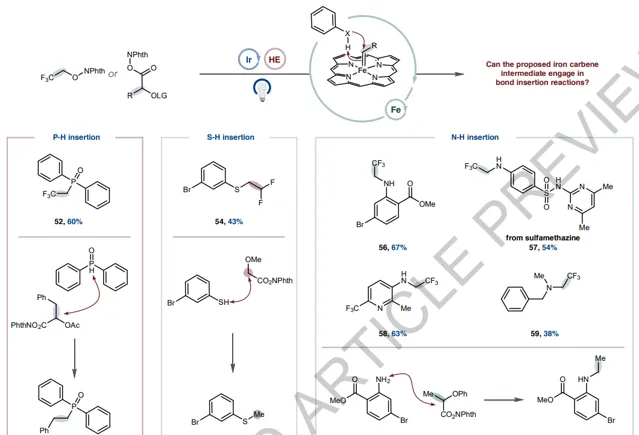
圖4. σ-鍵插入反應
總結,該研究展示了一種新穎的金屬光氧化還原策略,用於形成碳烯中間體,透過輻射加成和氧化還原反應生成所需的金屬碳烯中間體,擴充套件了傳統碳烯形成方法的範圍,實作了環丙烷化和X-H插入反應。這一方法克服了傳統方法的局限性,具有廣泛的套用前景。
聲明:僅代表作者個人觀點,作者水平有限,如有不科學之處,請在下方留言指正!











