原創 驕陽似我 圖靈基因 2022-07-06 08:03 發表於江蘇
收錄於合集#前沿分子生物學機制
撰文:驕陽似我
IF=31.743
推薦度:⭐⭐⭐⭐⭐
亮點:
T細胞衰竭限制了抗腫瘤免疫,但這一過程的分子機制尚不清楚。本文進行了全基因組CRISPR-Cas9篩選,以系統地發現T細胞耗竭的調節因子,從而確定了表觀遺傳因子的富集。小鼠和人類腫瘤模型的體內CRISPR篩選表明,INO80和BAF染色質重塑復合物的擾動改善了腫瘤中T細胞的永續性。體內擾動序列揭示了每個復合物的不同轉錄作用,包括Arid1a在內的典型BAF復合物成員的缺失導致效應程式的維持和腫瘤浸潤T細胞中耗竭相關基因的下調。最後,Arid1a耗竭限制了耗竭相關chromatin可及性的獲得,並導致抗腫瘤免疫的改善。總之,本文提供了一個T細胞耗竭的遺傳調節器圖譜,並證明表觀遺傳狀態的調節可以改善癌癥免疫治療中的T細胞反應。
T細胞衰竭是一個由慢性T細胞受體(TCR)刺激驅動的過程,導致抑制性表面受體的穩定表達、對腫瘤抗原的反應性差、細胞增殖和體內永續性低。T細胞衰竭最初是在慢性病毒感染的情況下發現的,現在被認為發生在各種疾病環境中,包括癌癥和自身免疫性疾病。研究表明,T細胞衰竭是檢查點阻斷和嵌合抗原受體T(CAR-T)細胞免疫治療的主要障礙,操縱這一過程可能會提高T細胞對癌癥的反應效率。
CRISPR-Cas9篩選已成為發現免疫細胞分化和功能分子決定因素的有力工具。例如,先前T細胞中的CRISPR-Cas9篩選已用於辨識體內T細胞命運的轉錄因子和代謝調節因子以及治療靶點。然而,擴大這些體內分析的固有局限性限制了這些篩選的文庫多樣性,在很大程度上阻礙了全基因組分析和T細胞表型新調節因子的公正發現。此外,同時篩選T細胞多種功能(例如,腫瘤中的組織定位、浸潤和分化)的分析也使得質疑特定基因擾動對T細胞功能和表型的單一方面的影響(例如耗盡)變得具有挑戰性。
近期,在
Cancer cell
雜誌上發表了一篇名為「
Genome-wide CRISPR screens of T cell exhaustion identify chromatin remodeling factors that limit T cell persistence
」的文章,開發了CD8+T細胞衰竭的體外模型,該模型概括了在體內觀察到的衰竭的表觀基因組特征,並可用於全基因組CRISPR-Cas9篩查。利用這個模型可篩選出對T細胞衰竭的遺傳調節因子,結果表明透過染色質重塑因子調節T細胞耗竭的表觀遺傳狀態可能是改善癌癥免疫治療中T細胞反應的有效途徑。

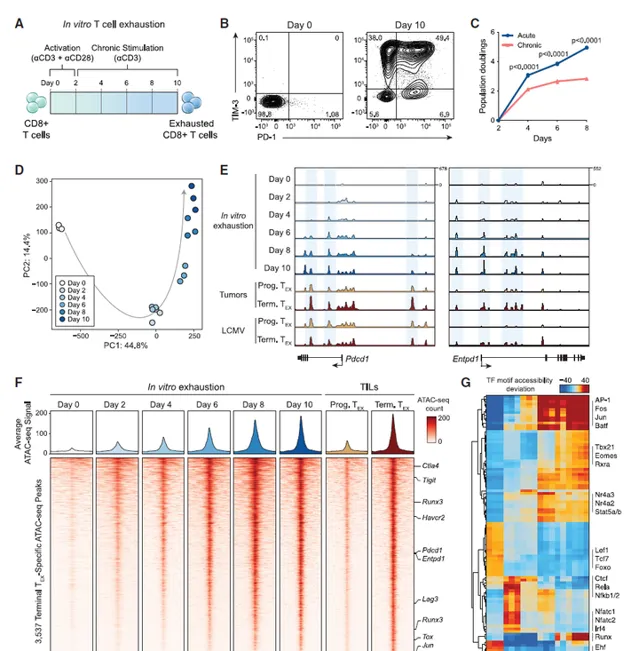
體外慢性刺激試驗再現了終末T細胞衰竭的表觀遺傳學程式
為了開發一種適用於全基因組CRISPR Cas9篩查T細胞衰竭的分析方法,本文使用抗CD3抗體來加強T細胞共受體CD3的聚集,從而以非抗原依賴的方式誘導慢性TCR訊號。該模型透過TCR復合物分離出T細胞衰竭慢性刺激的核心決定因素,並消除T細胞定位和轉運效應以及腫瘤微環境(TME)中的免疫抑制因子。在8天的抗CD3刺激過程中(抗CD3/CD28啟用2天後),抑制性受體PD-1和T細胞免疫球蛋白域和粘蛋白域3(TIM3)逐步上調,慢性刺激T細胞生長缺陷。接下來探究體外耗竭試驗是否再現了體內T細胞耗竭的表觀遺傳學特征。在慢性刺激過程中進行轉座酶可及性染色質測序分析(ATAC-seq),並分析染色質可及性圖譜。結果表明,體外T細胞衰竭試驗顯示出體內T細胞衰竭的標誌性功能和基因組特征。圖1:體外慢性抗原刺激試驗重現了T細胞衰竭的表觀遺傳學特征。
全基因組CRISPR篩選辨識T細胞衰竭的遺傳調節因子
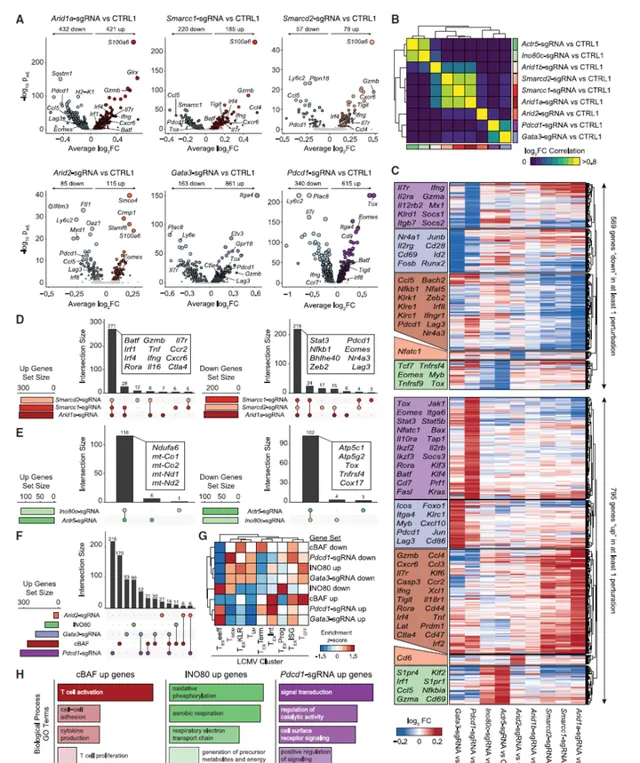
接下來調整體外耗竭試驗使其與CRISPR篩選適配。從Rosa26-Cas9敲除小鼠中分離出CD8+T細胞,用含有90230個sgRNA的全基因組逆轉錄病毒sgRNA文庫轉導細胞,在第4天將細胞分裂為急性(僅IL-2)和慢性(抗CD3和IL-2)刺激條件,並在第10天進行測序。篩查的陽性對照是TCR訊號通路的組成部份,因為這些因子的缺失會損害抗原驅動(或抗CD3驅動)訊號。因此,首先分析了CD3受體亞單位(Cd3e、Cd3d、Cd3g、Cd247)的富集情況,觀察到在兩個重復中針對這些基因的導向物的強烈富集。除了Cd3e、Cd3d和Cd3g外,篩選中的頂級富集基因還包括TCR訊號通路的其他已知成分,如Zap70、Lcp2、Lat和Lck,以及細胞粘附和整合素相關基因Fermt3、Tln1、Itgav和Itgb3。對前100名衰竭陽性調節因子的GO分析證實,「TCR訊號通路」高度富集。除了與TCR相關的GO分類外,其他與表觀遺傳學相關,包括「染色質重塑」和「核小體解體」也高度富集。事實上,對其他高富集基因的分析確定了許多染色質相關因子,包括Arid1a、Smarcc1、Smarcd2、Ino80、Actr8和Actr5。值得註意的是,共刺激和抑制受體Icos、Pdcd1、Ctla4、Cd28、Havcr2、Lag3和Tigit在螢幕上沒有明顯富集。在TFs中,Irf4、Junb、Eomes和Batf3被耗盡,而Tbx21和Nr4a3被耗盡適度豐富,支持之前關於其在疲勞中作用的證明。相比之下,對於衰竭的發展至關重要的Tox和Tox2並不是攻擊,這支持了之前的研究證明刪除這些因子可能不會改善體內T細胞的永續性。同樣,Jun和Batf也沒有命中,這表明雖然這些因子的過度表達可以提高T細胞的永續性,但缺失沒有顯著影響。總之,體外全基因組CRISPR-Cas9耗竭篩查提供了控制慢性抗原誘導T細胞耗竭過程的遺傳因子的全面目錄,並將染色質重塑因子確定為改善T細胞永續性的潛在靶點。圖2:T細胞衰竭的全基因組功能篩選。

染色質重塑因子限制T細胞在體內外的永續性
為了表征top hits的體內功能,在兩種小鼠腫瘤模型中篩選sgRNA。第0天雙側註射MC-38結腸腺癌或B16黑色素瘤腫瘤,將卵清蛋白異位表達到Rag1-/-小鼠中,並從Cas9/OT-1小鼠中分離出CD8+T細胞。第1天用客製的sgRNA轉導T細胞。在腫瘤接種後6天,每只小鼠移植13106個T細胞,在第15天采集小鼠的腫瘤和脾臟,從每個器官中分離T細胞,並對這些細胞中的大量sgRNA含量進行測序。如上所述計算sgRNA富集度,並合並所有小鼠的結果,建立每個腫瘤模型中每個基因相對於對照分布的總腫瘤LFC Z得分和脾臟LFC Z得分。含有TCR復合物/訊號sgRNAs的細胞辨識抗原的能力應受損,因此,與體外篩選相比,除了Itk外,其他細胞在體內被耗盡。然而,在兩種腫瘤模型中,一組選定的體外HIT在腫瘤和脾臟中高度富集,包括Arid1a、Itk、Smarcd2、B4GALT1、Gata3、Gpr137c、Trp53和Vstm4。在細胞景觀網絡的背景下視覺化每個基因的腫瘤富集顯示,體內的許多陽性命中是表觀遺傳因素,包括INO80復合物(Ino80c和Actr5)的亞單位和BAF復合物(Arid1a、Smarcd2和Smarcc1)。排名靠前的基因剔除可將腫瘤中的T細胞累積提高3.4倍。相比之下,缺乏Cd3d的T細胞減少了6.7倍,缺乏Cd3e的T細胞減少了3.3倍,這表明靶向頂部命中顯著提高了T細胞在腫瘤中的永續性。這些結果驗證了全基因組篩查,確定了僅在慢性抗原刺激條件下改善T細胞永續性的幹擾,而不是改善一般T細胞適應力,並提名BAF和INO80復合物進行進一步研究。圖3:靶向體內篩選辨識限制T細胞永續性的INO80和BAF復合物的亞單位。

調節cBAF活性可增強T細胞的永續性並改善腫瘤控制
接下來驗證Arid1a sgRNA細胞的永續性優勢,使用了一種細胞競爭試驗,其中細胞被單一靶向對照(CTRL1)sgRNA或Arid1a靶向sgRNA與不同熒光報告物轉化,混合,然後放入體外慢性刺激試驗或體內MC-38腫瘤模型。在體外和體內,與對照細胞相比,Arid1a sgRNA細胞表現出顯著增強的永續性。體外慢性刺激後,Arid1a sgRNA細胞表現出較低的PD-1和TIM3表面蛋白表達。最後評估了觀察到的Arid1a sgRNA細胞持續性增強是否會改善體內的抗腫瘤反應。將MC-38腫瘤接種小鼠,並在第6天移植用CTRL1逆轉錄病毒或Arid1a sgRNA逆轉錄病毒轉導的Cas9/OT-1 CD8+T細胞並監測腫瘤生長。到第15天,與對照細胞的轉移相比,Arid1a sgRNA細胞的轉移顯著改善了腫瘤清除率。與接受CTRL1 T細胞的小鼠相比,接受Arid1a sgRNA T細胞的小鼠的生存期顯著延長,三個最重要的命中部位位於cBAF復合體(Arid1a、Smarcc1和Smarcd2)中。相反,BAF核心不可替代亞單位的擾動或ATP酶模組成分有害,導致這些sgRNAs的耗盡。因此提出一個模型,調節(減少)染色質上cBAF的存在有利於T細胞的永續性。研究表明,ARID1A缺陷腫瘤染色質上的cBAF復合物水平降低(但未被清除),這導致關鍵轉錄因子(包括AP-1因子)的獲取減少。除cBAF外,還觀察到以PBAF復合物成員Arid2為靶點的sgRNAs正富集,而以ncBAF復合物成員Bicral、Bicra和Brd9為靶點的sgRNAs嚴重缺失。綜上所述,這些結果表明,擾動cBAF復合亞基基因可以改善T細胞的永續性和體內抗腫瘤免疫。圖4:CRISPR篩選和功能研究表明,調節cBAF活性可以增強抗腫瘤免疫。

體內擾動序列揭示TIL中染色質重塑復合物的不同轉錄效應
為了理解CRISPR篩選辨識的hits中促進T細胞功能改善的分子機制,進行了擾動序列分析,該分析同時捕獲單個細胞中的CRISPR sgRNAs和轉錄組。結果表明所有的擾動都包含來自每個簇的細胞,比例相似,表明每個靶基因的缺失可能不會影響細胞類別組成的整體變化,而是調節一個或多個簇中的基因表現。為了進一步研究這種可能性,聚集了含有針對相同基因的sgRNAs的細胞,並計算了與CTRL1細胞相比,每個擾動的不同基因表現,靶向cBAF亞單位Arid1a、Smarcd2或Smarcc1誘導T細胞轉錄程式中的共同全域變化,包括效應分子Gzmb和Ifng、細胞表面受體Cxcr6和Il7r以及TFs Irf4和Batf的上調。數據表明,cBAF和INO80染色質重塑復合物的亞單位在T細胞衰竭中具有不同的作用,這些作用在同一復合物中基本上是保守的,cBAF主要調節效應器和衰竭相關基因,INO80調節代謝。此外,tar染色質重塑因子的轉錄影響與先前已知靶點Pdcd1和Gata3的影響重疊最小,這表明有可能協同靶向多種途徑以改善T細胞功能。圖5:Cbaf缺失的T細胞表現出增強的效應基因特征和減少的末端耗竭。
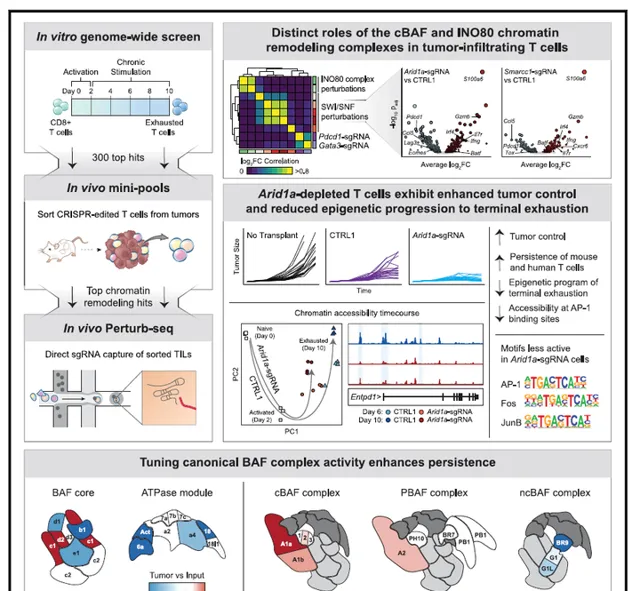
在這項研究中,在慢性刺激的T細胞中進行了全基因組CRISPR篩查,這提供了調節T細胞衰竭的全面基因圖譜。使用了一種互補的體外和體內篩選策略:(1)與全基因組CRISPR篩選相容的體外耗竭試驗的開發,使我們能夠與之前的篩選相比,擴大細胞數量和sgRNA文庫覆蓋範圍,提供了一種無偏的發現工具,(2)體內隨訪篩選發現幹擾顯著改善了免疫治療相關腫瘤模型中T細胞的永續性。圖6:文章總圖。
教授簡介:

Ansuman T . Satpathy
Ansuman Sattathy博士是史丹福大學醫學院病理學系的助理教授。他是史丹佛癌癥研究所、帕克癌癥免疫治療研究所、免疫學、癌癥生物學和生物醫學資訊學專案Bio-X的成員,也是ChEM-H的教員研究員。Sattathy博士在聖路易華盛頓大學獲得免疫學碩士和博士學位,在史丹佛醫院和診所獲得病理學臨床實習,在史丹福大學進行遺傳學博士後培訓。Sattathy博士的研究小組專註於開發和套用基因組級技術,以研究健康、感染和癌癥中免疫系統的基本特性。
參考文獻:
Belk et al., Genome-wide CRISPR screens of T cell exhaustion identify chromatin remodeling factors that limit T cell persistence, Cancer Cell (2022),
https://
doi.org/10.1016/j.ccell
.2022.06.001











