最近寫了一篇長文【關於維生素B12全合成的詳細解析】,就來這裏投一下。
相信看完之後,你就明白全合成的意義了。
------------
謹以此文,紀念維生素B12被人類發現90周年。
註:如果本文中有任何錯誤或疏漏,請務必聯系作者或在評論中寫出。不勝感謝!
1.前情提要
維生素B12 (\text{Vitamin B12} ,又名 鈷胺素 ,縮寫 \text{VB12} ),這種物質(其實嚴格來說是一類物質)如今早已家喻戶曉。作為唯一一種 含有金屬元素的維生素 ,其中心的 \ce{Co} 原子賦予了它鮮紅的色彩,也讓它有了一個別稱: 紅色維生素 。

巧合的是,鮮紅的維生素B12最重要的作用之一,就是為我們的身體 制造鮮紅的血液 。具體來說,維生素B12是一種 輔酶 ,參與紅細胞的制造與成熟,也參與某些胺基酸(如 蛋胺酸 )和 胸腺嘧啶 在體內的合成。總之,它在人體內發揮著非常重要的作用,是 維持正常代謝和機能不可或缺的物質 。
同時,維生素B12是也 結構最復雜的維生素 。它的化學式為 \ce{C63H88N14O14PCo} ,分子量高達 1355.37 ,擁有一個 咕啉 (corrin )大環(註意它與 紫質 結構的區別)、一條結構類似於 核苷酸 的長鏈、14 個具有手性的碳原子和一個在中心配位的 鈷原子 ,如下圖:
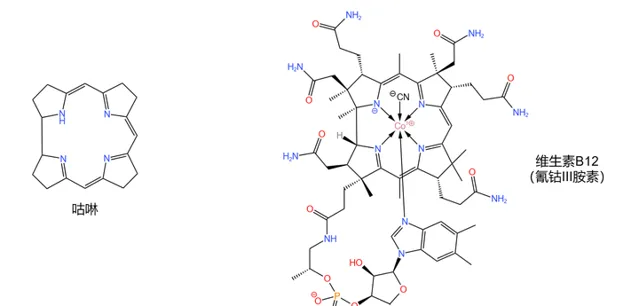
(註:嚴格來說, 氰鈷 \text{(III)} 胺素 只能算是維生素B12的一種,但一般可以把它當做維生素B12的代表。下文中所有「維生素B12」字眼基本都指代這一物質。)
雖然維生素B12對正常生理活動非常重要,但是高等動植物卻 不能自行制造維生素B12 。自然界中,這種物質主要依靠 細菌 等微生物供給,而我們則必須依靠攝食來補充。
人類對維生素B12的認識是 漫長而曲折 的。19 世紀 50 年代,英國醫生 Addison 首次描述了一種致死的 惡性貧血 ,並行現這種疾病與患者的 胃部受損 有關。之後的幾十年間,人們一直在試圖搞清楚這種病的根源,但進展寥寥。直到 1929 年,美國科學家 Castle 提出了著名的 雙因子理論 來解釋發病機制:病人由於胃部受損,缺乏一種 內因子 (intrinsic~factor ),導致其無法從食物中吸收一種 外因子 (extrinsic~factor ),進而導致患病。
剛開始,許多科學家都對這套理論不以為然。直到 1934 年,G.~Whipple 、G.~Minot 和 W.~Murphy 三人真的發現且分離出了這種「外因子」,並將其取名為 維生素B12 ,對應的爭論才偃旗息鼓。三人也因為這項重大成果獲得了諾貝爾生理學或醫學獎:

(上圖:三位發現維生素B12的科學家)
1948 年,Rickers~E.~L. 等人得到了 純的維生素B12 。隨後,對其復雜結構的破譯轟轟烈烈地展開。8 年之後,1956 年,D.~Hodgkin 等人用 X射線繞射 法徹底破解了它的結構,並因此獲得了 1964 年的諾貝爾化學獎。
好,既然結構已經確認,那麽下一步當然就是合成這種物質。可是,它的結構是 如此巨大而復雜 ,簡直令人望而生畏。當時的化學家們都將其稱為 有機合成界的珠穆朗瑪峰 。(雖然後面又出現了更加復雜的物質(Link:巖沙海葵毒素的全合成)拿走了這一稱謂)
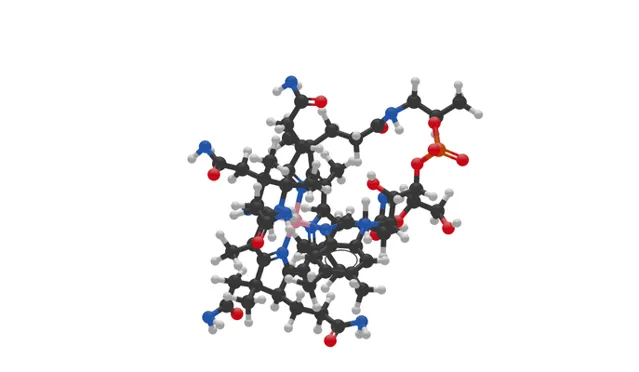
(上圖:維生素B12的球棍模型,其中黑色:C ,白色:H ,紅色:O ,橙色:P ,藍色:N ,粉色:Co )
但是,人類並不會因此放棄。
從 1959 年開始,瑞士化學家 A.~Eschenmoser 等人就開始致力於攀登這座高峰,成為了這項工作的 先行者 。1960 年,德國化學家 Bernhauer~K. 等人加入了攀登者的行列,並成功完成了從 鈷啉胺酸 (cobyric~acid )到維生素B12的 半合成 。1961 年,剛剛完成 葉綠素A 全合成(Link:葉綠素A的全合成)的「 有機合成藝術家 」R.~Woodward 帶領著他的課題組加入了進來,並很快與其他研究者取得合作。最終,1972 年,在整整 13 年的光陰之後,這項超過 100 位研究者參與的、跨越半個地球的「 有機合成化學史上最瘋狂的工作 」終於宣告成功。

(上圖:【維生素B12的全合成】論文影,1973 ,伍德沃德。參與工作的其他課題組也發表了各自的論文。)
在下文中,我們將會詳細討論這條凝聚了上百人心血的維生素B12全合成路線。 不要因為它的復雜而感到畏懼 ,請相信我,當你逐漸理解它的時候,你會發現它的精巧和美麗。它是一件巧奪天工的藝術品。
在上帝創造的自然界的旁邊,化學家們又創造了一個新的世界。 ——伍德沃德,19562.概述
與葉綠素A一樣,維生素B12也是一個 相當脆弱的分子 。它只有在 \text{PH}=4.5-5.0 的狹小區間內才能長時間穩定,而一旦 \text{PH}>7 或是 \text{PH}<2 就會迅速分解。它的熱穩定性也不好,在 100^{\circ}C 以上也會徹底分解。這無疑是給全合成工作帶來了巨大的挑戰。
但是,這還並不是合成過程中最大的難點。前面提到,維生素B12擁有一個 咕啉大環 (下圖中紫色部份)——這是整個分子的 核心結構 。它由 4 個 氫化的吡咯環 拼接而成,具有顯著的 不對稱性 。由於無法形成 \pi 電子的環流,咕啉環 沒有芳香性 ,性質十分脆弱,且周邊分布著眾多的 手性碳原子 。當時的手性合成技術還遠沒有現在成熟,因此在維生素B12之前,人們還從來沒有成功合成過咕啉衍生物。
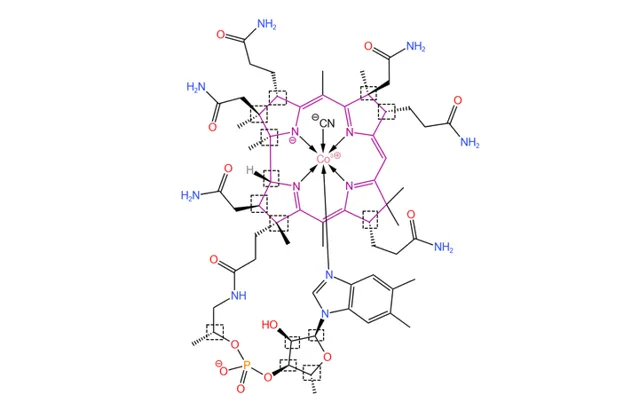
(上圖中:紫色標出了咕啉結構;虛線框框出了所有手性碳原子)
1960 年,分子下方的那條類似於核苷酸的長鏈被 Bernhauer~K. 等人成功合成——這也算是全合成中的 第一個階段性成果 。於是,後續合成工作的目標變成了 鈷啉胺酸 (如下圖),而咕啉結構的構建也隨即成為了核心問題:
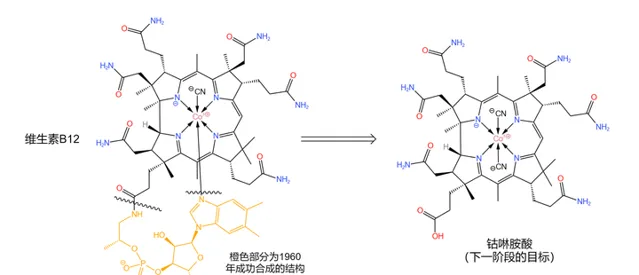
解決這一問題的思路是 將整個分子劈成兩半 (如下圖),然後再將它們拼接到一起。其中,左半部份被命名為 cyanobromide ,由 R.~Woodward 的團隊負責合成;右半部份被命名為 thiodextrolin ,由 A.~Eschenmoser 的團隊負責合成:
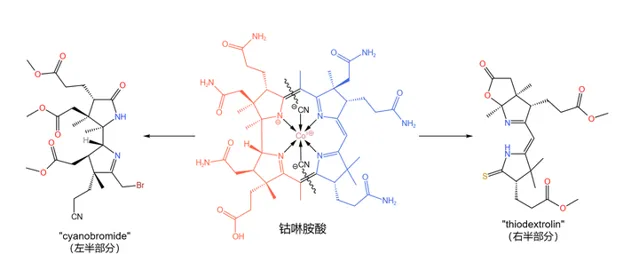
現在,分工已經確定,全合成的介紹也將正式開始。
本文中涉及的主要有機反應清單:
- Kucherov 加成;
- Wittig 反應;
- Birch 還原;
- Criegee 臭氧化反應;
- 羥醛縮合反應;
- Beckmann 重排;
- Diels-Alder 反應;
- Arndt-Eistert 同系增碳反應;
- Eschenmoser 偶聯反應;
- Eschenmoser 醯胺水解反應;
- Meerwin 鹽的烷基化反應。
3.逐步合成分析
3.1 左半部份的合成
左半部份的合成起始於一種普通的 吲哚 衍生物——6- 甲氧基-2,3- 甲基吲哚——雖然現在它看上去似乎與目標完全不沾邊。首先,用 格式試劑 (這裏使用的是 甲基碘化鎂 ,\ce{MeMgI} )與 溴丙炔 與它反應,在 3 號位上接上一個 炔丙基 :
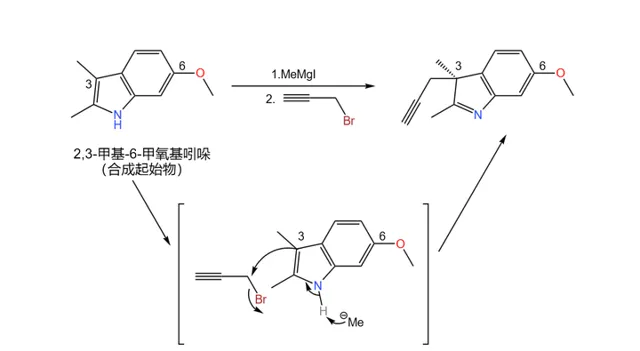
實際上,這個反應的立體選擇性並不好,得到的產物是 外消旋體 ,在後續的步驟中會將其分離。
下一步,在 路易斯酸 (此處使用 \ce{BF3} )與 \ce{Hg(II)} 物種的催化下,碳碳三鍵與甲醇發生著名的 Kucherov 加成反應,得到 烯基醚 ;隨後,分子內自發環化,最終得到一個三環結構的酮:
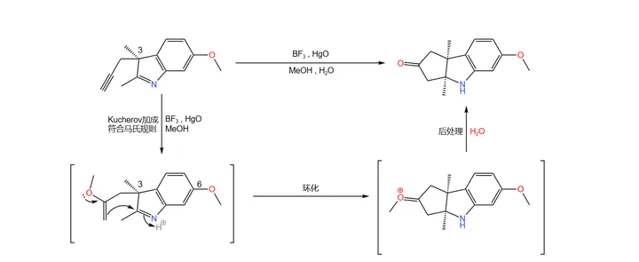
(註:由於 3 號位有甲基的存在,導致 有一側的進攻受阻 ,因此產物的立體構型是單一的。)
現在,我們先把產物放在一邊備用,來處理第二個合成起始物。它被稱作 樟烯酸甲酯 (methyl~laurolenate ,見下圖),是 樟腦 經過一系列反應後得到的產物,很早之前就被人們合成。伍德沃德之所以選擇它,主要是因為它擁有一個繼承自樟腦的手性碳原子。
首先,用 氫化鋁鋰 (\ce{LiAlp} )處理 \text{(S)}- 樟烯酸甲酯,將其還原為醇;隨後再用 鉻酸 (\ce{pCrO4} )氧化,得到一種醛;最後,使用著名的 Wittig 反應得到一個碳碳雙鍵:
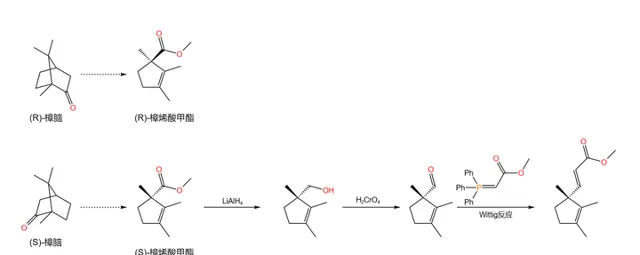
Wittig 反應是一個重要的烯烴合成反應,其機理在之前的幾篇文章中都有提及,在此便不再贅述。
接著,我們用酸將得到的酯水解,再用 氯化亞碸 (\ce{SOCl2} )將其變為 酰氯 。酰氯隨即與剛才合成的那個三環結構的酮反應,兩者結合在一起形成醯胺結構:
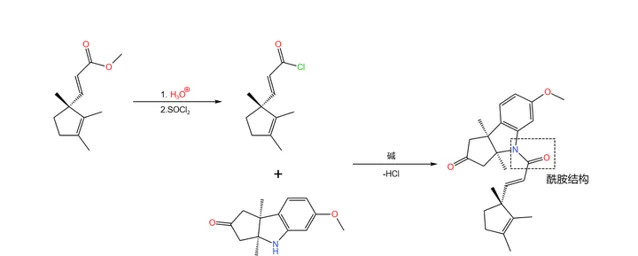
隨後是一個精彩的環化反應:在 丁醇鉀 (\ce{t-BuOK} )的作用下,19 號碳原子上的氫原子被奪去,形成 烯醇負離子 ;烯醇負離子進攻附近 \alpha,\beta- 不飽和的羰基環化。由於 分子的構型已經固定 ,進攻只有一個方向,因此得到了單一立體構型的產物:
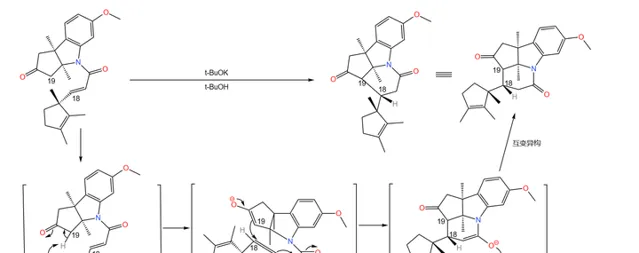
(註:這裏的編號表示了該碳原子最終在咕啉環中的位置)
接下來,用 乙二醇 (\ce{HO(Cp)2OH} )保護 2b 號碳原子上的酮羰基。由於分子中還有一個醯胺結構(位於 18b 號碳原子),所以我們還得用 Meerwin 鹽再次進行保護(註:醯胺中的羰基無法被乙二醇保護):
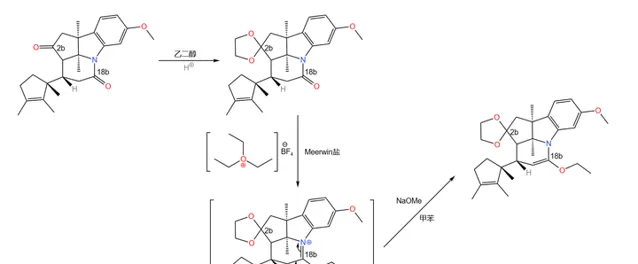
之所以要這樣做,是因為下一步要用到一個比較強烈的反應,即著名的 Birch 還原反應。在 液氨 中,用過量的堿金屬(這裏使用 Li )處理這一物質,右上方的苯環被還原為 環己二烯 結構;隨後用酸處理之,經過 雙鍵移位 後得到 \alpha,\beta- 不飽和酮;同時,上一步的保護也被脫去:
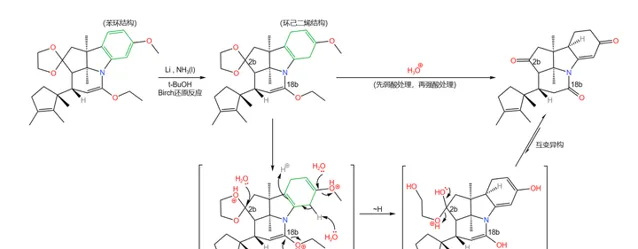
Birch 還原是非常經典的 自由基還原反應 ,在有機化學史上具有重要的地位。反應機理如下圖所示:
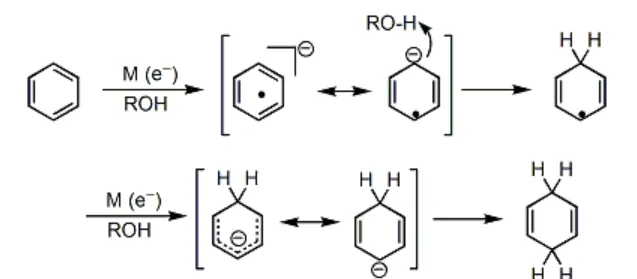
顯然,對於帶有 取代基 的苯環來說,最終生成的烯烴的位置選擇性,是由 中間體的穩定性 決定的。一般來說,連線著 吸電子基團 (\text{EWG} )的碳原子最終不會帶有雙鍵,而連線著 給電子基團 (\text{EDG} )的碳原子最終會帶有雙鍵。例如:
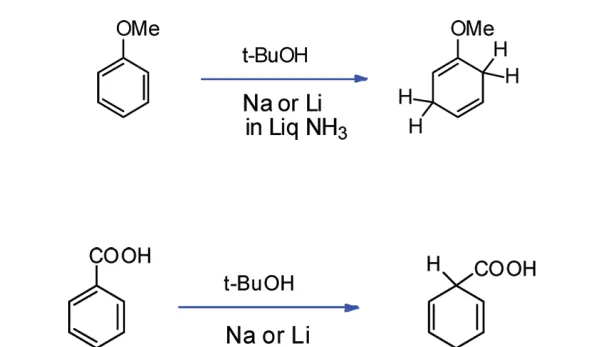
(註:想要更深入了解 Birch 還原的位置選擇性的讀者請見參考文獻 [11] )
如果具體到我們這個反應,你會發現:苯環的 a,b,d 三個位置都帶有給電子基團,所以 還原產物是單一的 。沒錯,這也是伍德沃德刻意的設計:
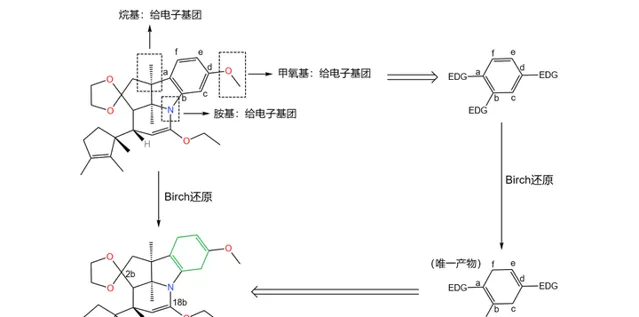
應該說,課題組的設計總體來說是成功的——兩步反應的總產率達到了驚人的 90\% 。但它們很快發現了一個問題:產物中 3 號碳原子的 構型與預料中的不符 。
理論上,從 化學動力學 角度,由於附近甲基的 空間位阻 ,\ce{H} 原子應該結合在甲基的異側;但從 化學熱力學 角度,\ce{H} 原子與甲基在同側時能量更低,也就更加穩定。但實際是,我們得到的 幾乎全是熱力學控制的產物 ——而那並不是我們想要的。課題組嘗試改變反應條件,但都無濟於事:
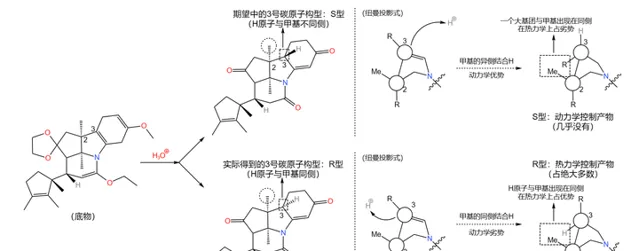
在關鍵時刻,伍德沃德表現出了超乎常人的冷靜。經過分析,它認為:3 號碳原子是特殊的,在特定條件(比如酸性或堿性條件)下,它可以透過 互變異構 的方式轉換自己的構型(註:一般來說,構型固定之後不會輕易翻轉,因為 構型翻轉需要斷開化學鍵 )。由於 物質總是自發地趨向於穩定 ,所以並不是我們制不出 S 型,而是 S 型產物會迅速變成在熱力學上更穩定的 R 型:
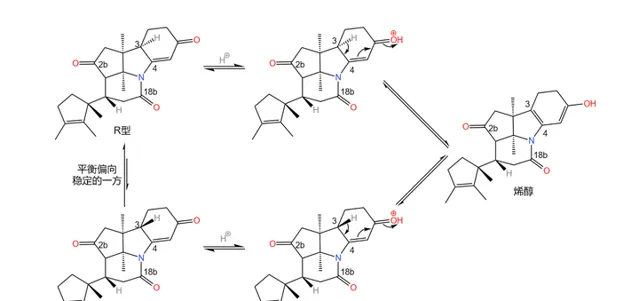
既然如此,我們是不是也可以利用這一特性,把構型翻轉回來?只需要透過某種手段,讓 S 型比 R 型在熱力學上更穩定就行了。於是,他在論文中寫道:
我們相信,如果他能在我們不需要的時候大量生成,那麽至少在原理上,對它進行必要的翻轉不是一件困難的事情。 ——【在天然產物全合成中的最新進展】,伍德沃德,1968他決定,暫時先不管這個構型問題,繼續原有的計劃。
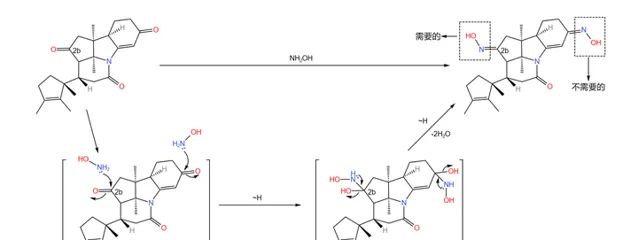
下一步,用 羥胺 (\ce{NpOH} )處理產物,把分子中的兩個羰基都變成 肟 。事實上,只有 2b 號碳原子上的肟是我們需要的,但是對於羥胺來說,兩個羰基的活性差不多(即使其中一個羰基是 \alpha,\beta- 不飽和的),因此我們很難在這一步區分二者,只好先把它們全部變成肟:
當然,我們還要把那個不需要的去掉。在非常溫和的條件下,用一定量的 亞硝酸 (\ce{HNO2} )與乙酸處理,可以把不需要的那個 \alpha,\beta- 不飽和的肟基除掉,而 2b 號碳原子上的肟基不受影響:
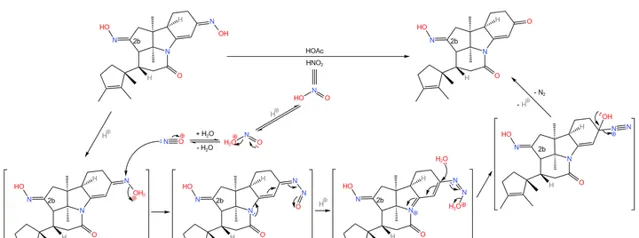
事實上,2b 號碳原子上的肟基並不會馬上用到,但後續的反應會產生越來越多的羰基,如果把這一步放到後面,那反應將 更加難以控制 。讀者可以先猜一猜這個肟基後續會發揮什麽作用。
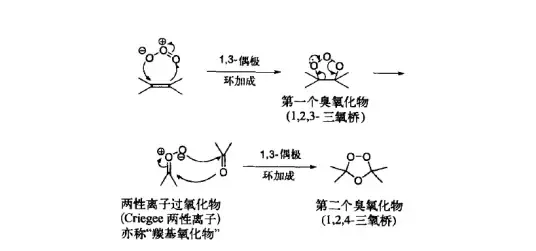
回歸正題,接下來登場的是著名的 Criegee 臭氧化反應。在低溫下用臭氧處理該物質,分子內的兩個碳碳雙鍵被開啟,形成 臭氧化物 中間體;隨後,加入 高碘酸 (\ce{pIO6} )氧化;最後,加入 重氮甲烷 (\ce{CpN2} )進行酯化:
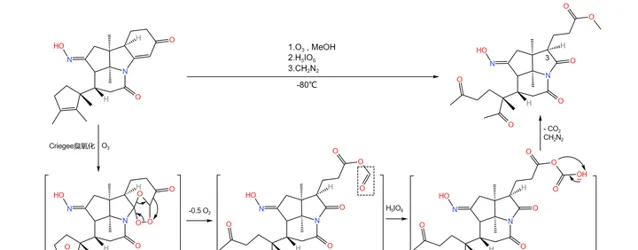
生成 臭氧化物中間體 的機理如下圖所示。由於這一中間體很不穩定,所以 Criegee 臭氧化一般需要在低溫下進行。
接下來,在 四氫吡咯 的催化下,分子左下角發生經典的 羥醛縮合反應 ,得到 \alpha,\beta- 不飽和酮的結構;隨後,用 甲磺酰氯 (\ce{MsCl} )處理,將 2b 號位上的肟基保護起來;最後,再來一遍 Criegee 臭氧化,雙鍵斷裂,得到 17c 號位的酯結構:
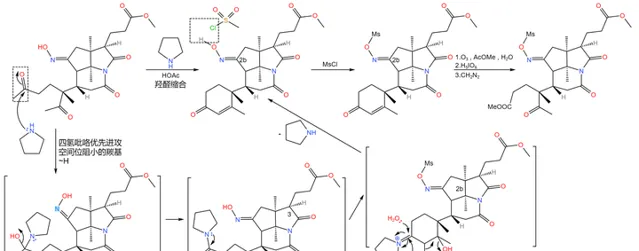
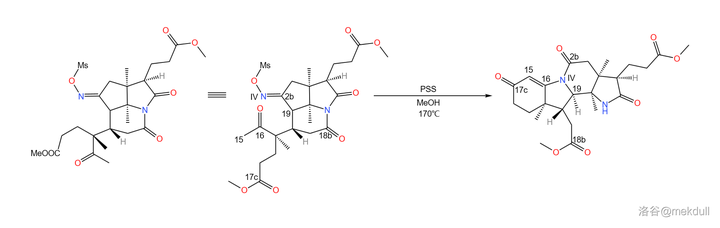
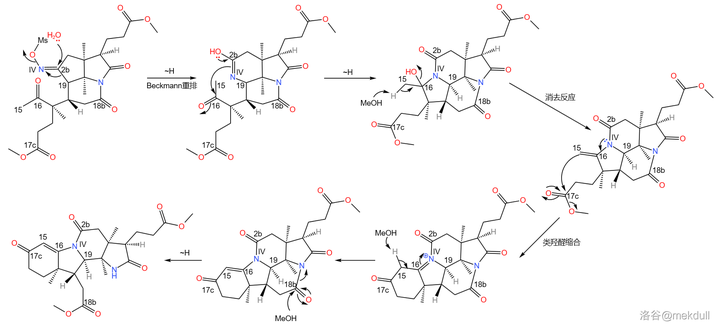
之所以如此大費周章,是因為伍德沃德準備要下一局大棋。現在,2b 號位上的肟基終於真正要出場了——它將引導著名的 Beckmann 重排反應。在 170^{\circ}C 下,用 聚苯乙烯磺酸 (\ce{(C8H8O3S)_{n}} ,縮寫 \ce{PSS} )和甲醇處理之,首先發生碳骨架重排,19 號碳原子與 2b 號碳原子分離;隨後,\ce{IV} 號氮原子 親核進攻 附近 16 號碳原子的羰基,形成一個 五元環 ;接著,中間體消去 1 分子水,形成 15,16 號碳原子上的雙鍵,從而形成 烯胺 結構;最後,烯胺 親核進攻 附近 17c 號碳原子上的酯基,在類似於羥醛縮合的反應後形成一個六元環狀的 \alpha,\beta- 不飽和酮結構。與此同時,在 18b 號位上,原來的內醯胺環被開啟,從而完成整個反應歷程:
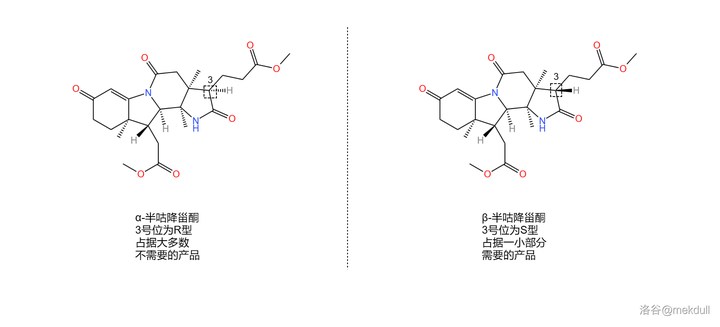
或許你已經在感嘆這個反應的巧妙,但相信我,精彩並未結束。我們得到的產物被命名為 半咕降甾酮 (corrnorsterone ,關於這個名字有興趣的可以看下面的「說文解字」)。還記得 3 號位那個錯誤的構型嗎?課題組發現,在一系列反應後,居然有 一小部份產物的構型又翻了回來 。也就是說,我們實際得到的是兩種 對映異構體 的混合物。為了便於區分,課題組在它們的名字前加上了 \alpha- 和 \beta- 的字首,如下圖:
 說文解字
:\text{corr-norster-one}
(半咕降甾酮) 「corr
」是單詞 corrin
(咕啉)的一半,表示這種物質最終會變成咕啉環的左半部份; 「norster
」源自單詞 norsteroid
(
降甾醇
,也泛指
去甲甾族化合物
),表示如果把 N
原子換成 C
原子的話,那麽這個物質就具有降甾醇的碳骨架; 「one
」是酮類化合物的字尾,源自單詞 ketone
。
說文解字
:\text{corr-norster-one}
(半咕降甾酮) 「corr
」是單詞 corrin
(咕啉)的一半,表示這種物質最終會變成咕啉環的左半部份; 「norster
」源自單詞 norsteroid
(
降甾醇
,也泛指
去甲甾族化合物
),表示如果把 N
原子換成 C
原子的話,那麽這個物質就具有降甾醇的碳骨架; 「one
」是酮類化合物的字尾,源自單詞 ketone
。
雖然構型翻轉回來的只占了一小部份,但這給了課題組解決問題的希望。他們很快又發現,2b 號位上的 內醯胺 結構可以在強堿的作用下斷裂。於是,一個精妙的翻轉構型的方法出現了。
觀察 2 號碳原子,你會發現它左側的 2b 號碳原子因為內醯胺結構而 被「鎖」在了一個固定的位置 ,連帶著附近的 2a 號碳原子也無法自由移動。這就相當於,2 號碳原子的左側是一個「 動不了 」的基團,所以空間位阻自然也比較小。而一旦我們用強堿把內醯胺環開啟,那麽這個基團就會重新「獲得自由」, 產生巨大的空間位阻 。
那這又有什麽用呢?前面提到,3 號碳原子是特殊的,在合適條件(比如酸性或堿性條件)下,它的構型可以 透過互變異構翻轉 。我們觀察到,在 \alpha- 半咕降甾酮中,3 號碳原子右側的 丙酸酯基 與 2 號碳原子左側的基團是 位於同側 的。原來在被「鎖住」時,由於空間位阻小,這種構型在熱力學上是有優勢的,但現在那個 被鎖住的已經「解放」了 ,空間位阻急劇增大,這種構型就變成了兩個大基團貼在一起, 熱力學上的優劣就此逆轉 。於是,3 號碳原子的構型翻轉,從 R 型變成了 S 型。最後,我們只需要重新加酸至中性,分子就會重新環化——此時就算分子發現自己被耍了,構型也 變不回去 了,因為堿性條件已經喪失。就這樣,我們成功把 \alpha- 半咕降甾酮變成了需要的 \beta- 半咕降甾酮:
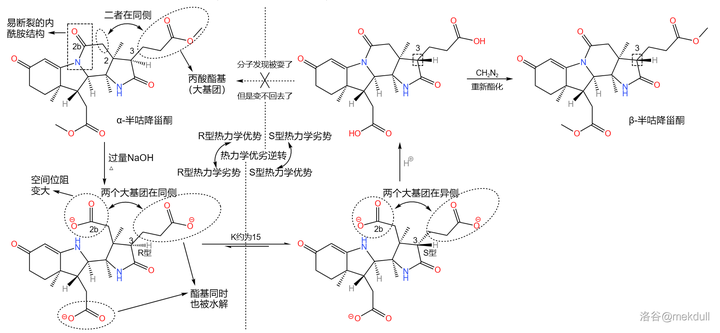
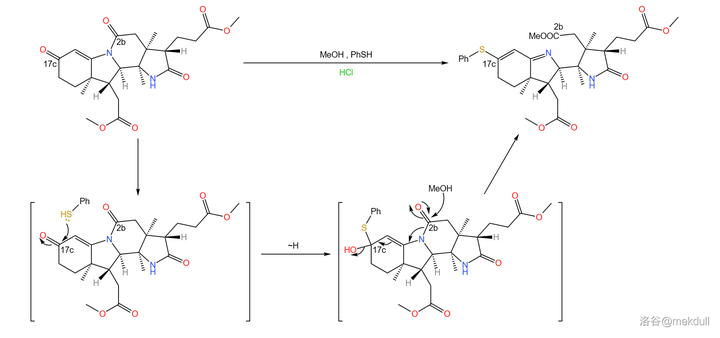
接下來,在酸性條件下,用甲醇和 苯硫醇 (\ce{PhSH} )的混合物處理 \beta- 半咕降甾酮。由於活性差別,二者會分別進攻 2b 號位和 17c 號位上的羰基。最終,六元內醯胺環斷開,17c 號位上形成 硫醚 結構。
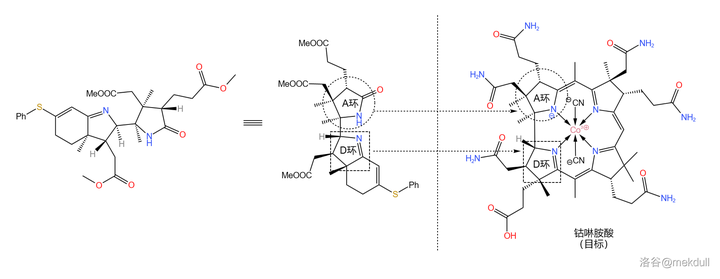
現在,我們手上的物質到底對應咕啉環的哪個部位已經可以看得很清楚了。如果你覺得不夠清楚,那我們就把它旋轉一下:
隨後,在低溫(-90^{\circ}C )的甲醇中用臭氧處理該物質,雙鍵斷裂,並在 17c 號位上生成 \ce{-COSR} 的結構。接下來,用液氨處理之,17c 號位上形成末端醯胺結構:
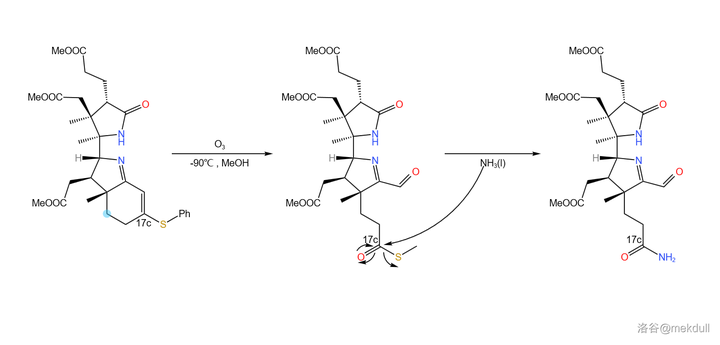
(註:其實 \ce{-COSH} 這個基團是有一個專有名的,讀作you基,\ce{-COSR} 則名為you酯基,但我死活打不出來這個you字,還請各位指教;下文中我會把 \ce{-COSR} 稱為「 硫酯 」,而把 \ce{-CSOR} 稱為「 硫羰酯 」,請註意區分)
最後一步,在還原劑 硼氫化鈉 (\ce{NaBp} )的作用下,15 號位上的醛被還原為醇;加入過量的 甲磺酸酐 (\ce{MsOMs} ),將醇甲磺酰化的同時為 17c 號位上的末端醯胺脫水,得到一個 氰基 (\ce{-CN} );最後加入 溴化鋰 ,左半部份「cyanobromide 」的全合成就大功告成了:
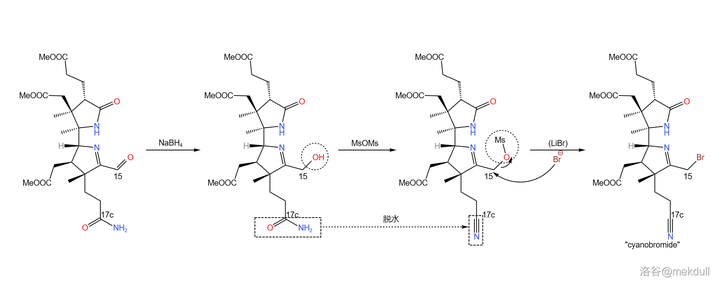
然而,這也只是一半而已。接下來,舞台交給 Eschenmoser 的課題組,他們將要帶我們去看看,分子的右半部份(「thiodextrolin 」)是怎麽合成出來的。
3.2 右半部份的合成
相比於 Woodward 課題組的工作,Eschenmoser 課題組設計的合成路線更為簡短,但同樣精妙。
右半部份的合成起始於三種結構簡單、產量巨大的重要化工原料: 乙醛酸 (\ce{HOCCOOH} )、 丁酮 (\ce{CpCOCpCp} )和 丁二烯 (\ce{Cp=CHCH=Cp} )。前兩者在酸催化下發生 交叉羥醛縮合反應 ,得到一種烯基酮酸;隨後,在 四氯化錫 (\ce{SnCl4} ,作為 路易斯酸 )的催化下,該物質與丁二烯發生著名的 Diers-Alder 反應,得到一種環己烯的衍生物:
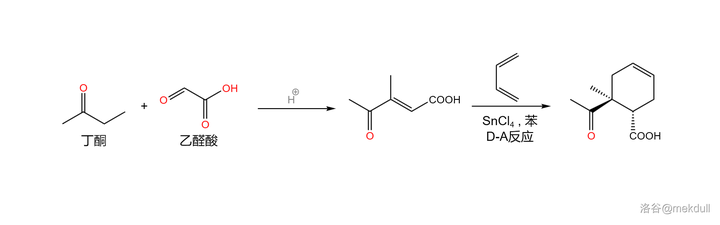
Diers-Alder 反應(又名 雙烯加成反應 )在有機合成中非常重要,其機理在前幾篇文章中已有提及,而在這篇文章的後記中,我還會簡要說明全合成工作為這個反應帶來的發展。
接下來,用過量的 Jones 試劑( 三氧化鉻 (\ce{CrO3} )溶於 濃硫酸 )處理該物質,環狀烯烴結構的雙鍵隨即斷裂(此處反應條件非常強烈,一般來說 Jones 試劑不會氧化雙鍵),生成一種帶有三個羧基的中間體;該中間體隨後 自發環化 ,形成 雙內酯 結構,產率 75\% :
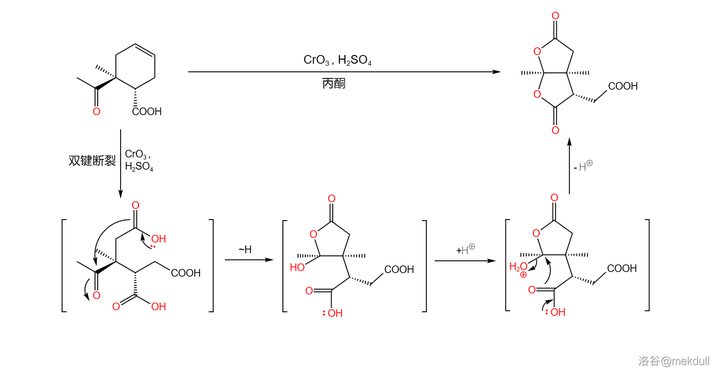
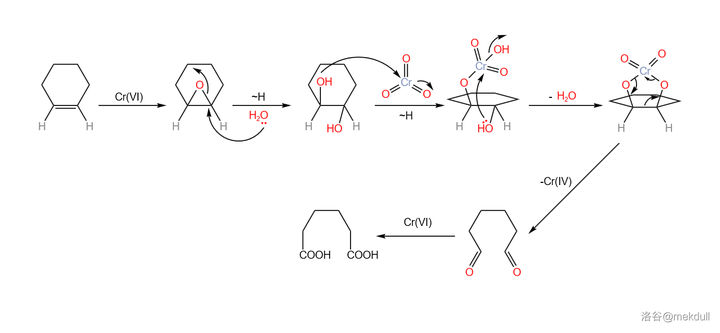
關於 \ce{Cr(VI)} 氧化劑斷裂雙鍵的機理,一般認為是先生成 環氧化合物 ,隨後生成 鄰二醇 ,最後在過量氧化劑的作用下,碳碳鍵斷裂,得到二酸產物:
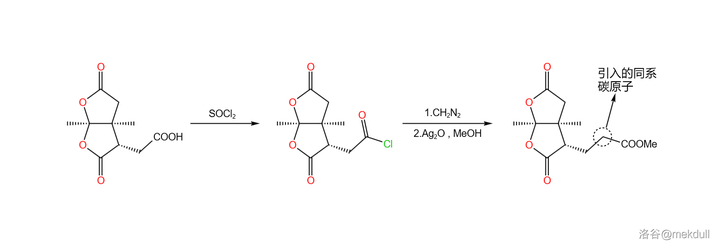
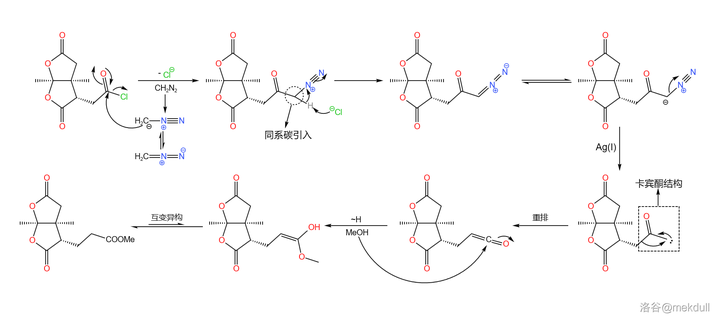
言歸正傳。下一步要用到的是 Arndt-Eistret 同系增碳反應,顧名思義,這個反應可以為羧基 增加一個同系碳原子 。在 \ce{SOCl2} 作用下,分子內的羧基首先變成酰氯;加入 \ce{CpN2} ,在親核取代之後,同系碳原子隨即被引入;在 \ce{Ag(I)} 的催化下,分子放出 \ce{N2} 形成 碳烯酮 中間體,隨後發生重排反應,最終在 \ce{MeOH} 的作用下變成酯,三步反應總產率 69\% :
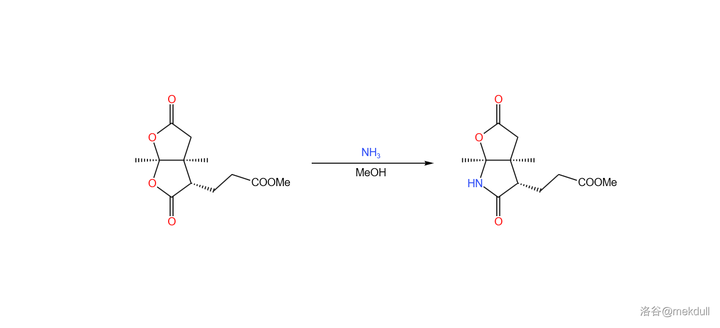
隨後,在甲醇中用定量的 \ce{Np} 處理該物質,可以 將其中一個內酯基團轉化為內醯胺 。由於特殊的 雙內酯結構 ,該物質的羰基具有更強的親電性,所以在室溫下反應就可以快速進行:
反應產率約為 55\% (其余的 45\% 大多都是另一個內酯基團被變成了內醯胺)。可見,這個反應的選擇性其實並不顯著。
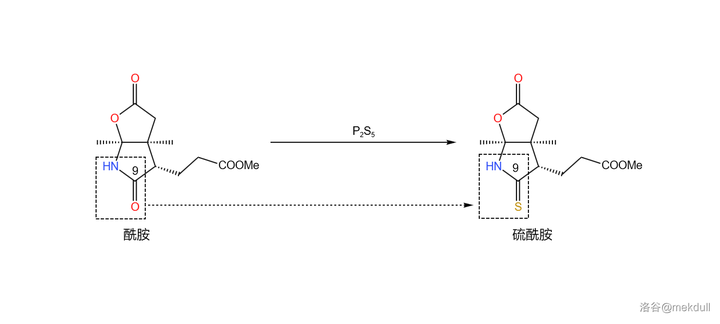
但不管怎樣,55\% 的產率也算是能接受了。現在讓我們 把產物分成兩份 ,並對它們 進行不同的處理 。第一份的處理很簡單,在 \ce{THF} 中,用一定量的 五硫化二磷 (\ce{P2S5} )進行硫化,9 號位的內醯胺結構被轉化為 硫內醯胺 ,而分子中的其他酯基則不受影響:
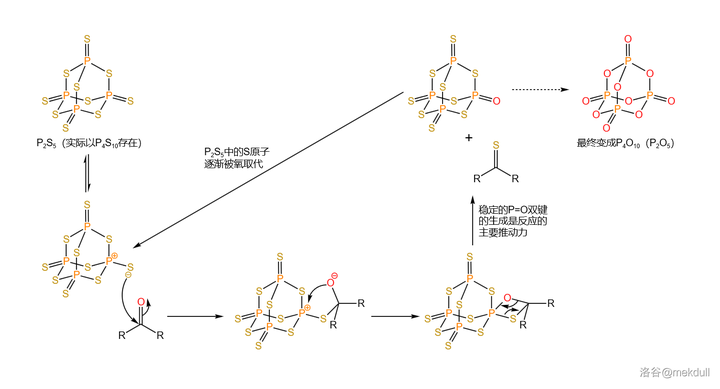
五硫化二磷 (\ce{P2S5} )的分子結構與所謂 五氧化二磷 (\ce{P2O5} )類似,實際上是以 \ce{P4S10} 形式存在的。作為一種重要的化工原料,它在有機合成中經常被用於將 羰基 轉化為 硫羰基 。後來,人們又以它為基礎制得了威力更強的版本,也就是著名的 勞森試劑 (Lawesson's~Reagent )。\ce{P2S5} 硫化的機理如下,有點類似於 Wittig 反應的機理:
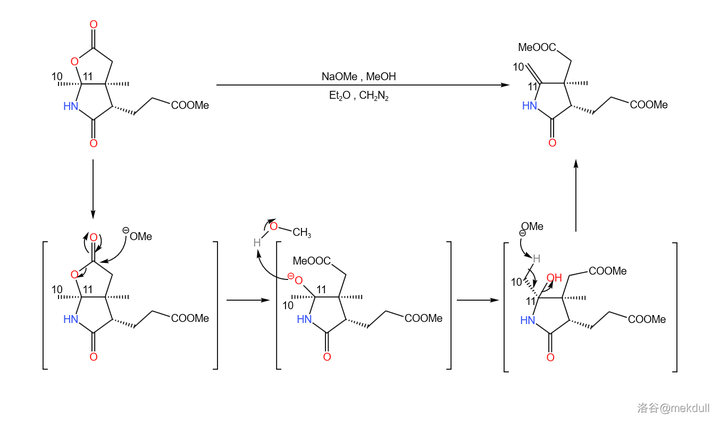
扯得有點遠,讓我們來看看第二份是怎麽處理的。在 乙醚 (\ce{Et2O} )中,用 \ce{NaOMe} 裂解內酯環,隨即消去 1 分子水生成 10,11 號位上的雙鍵;為了防止需要的酯基被水解,反應體系中還添加有一定量的 \ce{CpN2} 。最終產率約為 \ce{92\%} :
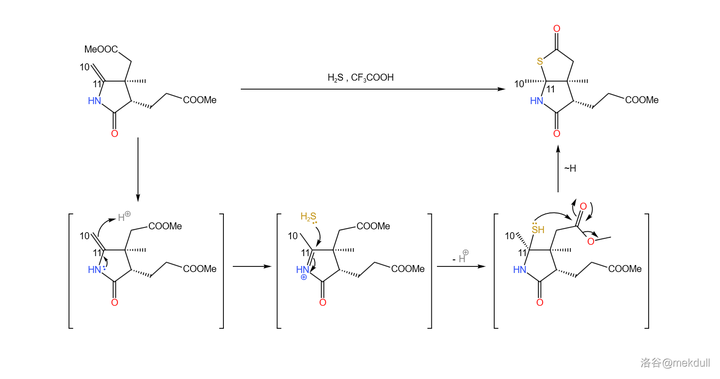
接下來,在 三氟乙酸 (\ce{CF3COOH} ,縮寫 \ce{TFA} )的作用下,該物質與 \ce{pS} 加成(與加 \ce{pO} 的機理類似)。隨後,硫原子進攻附近的酯基,形成五元環狀硫酯(\ce{-COSR} )結構:
之所以要大費周章把它搞成硫酯,是因為在 威爾金森催化劑 (\ce{(PpP)3RhCl} )和 氰化鈉 (\ce{NaCN} )的作用下,硫酯容易發生 脫硫化羰反應 ,從而把那個不需要的碳原子去掉;隨後再用 \ce{Ag+} 處理,得到 10,11 號位上的雙鍵。這個反應同時也會產生一種有三元環結構的副產物,因此產率並不是很高:
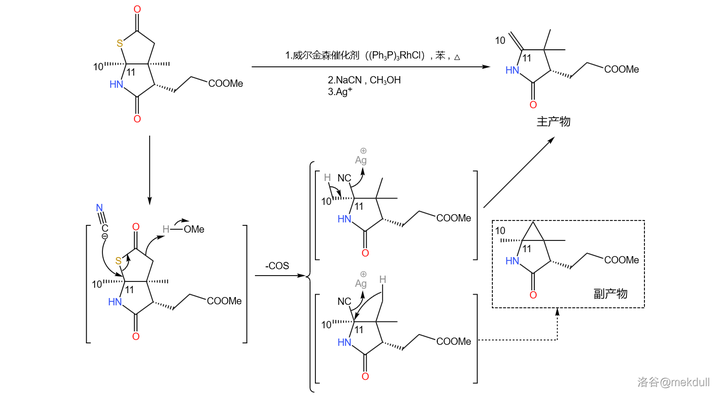
(註:由於涉及過渡金屬催化,機理相當復雜,所以 此處展示的機理是簡化過後的 。想要進一步了解的讀者可以自行查閱相關文獻。)
好,現在兩份都已經完成了各自的處理,是時候把它們 結合起來 了。為了這一步,Eschenmoser 開創了一個全新的反應 ,也就是如今已被我們所熟知的 Eschenmoser 偶聯反應。
Eschenmoser 偶聯反應需要一個 硫醯胺 和一個 烯胺 。在 過氧化苯甲酰 (\ce{PhCOOOCOPh} )的作用下,兩分子硫醯胺首先發生 氧化自偶聯 ;隨後,烯胺進攻自偶聯產物, 二硫鍵 斷裂得到 硫橋 結構,又自發異構化為 環硫化合物 ;最後在 \ce{P(III)} 化合物(此處使用 三乙氧磷 ,\ce{P(OEt)3} )作用下,硫原子被拔去,完成整個偶聯反應:
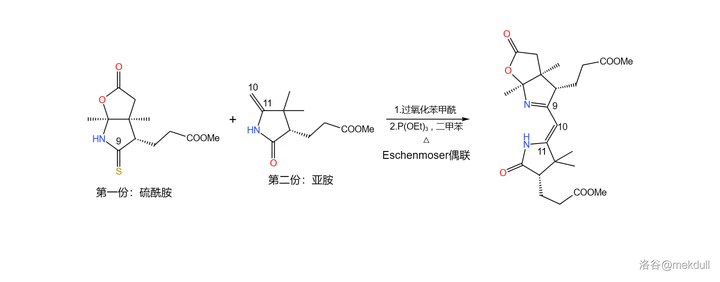
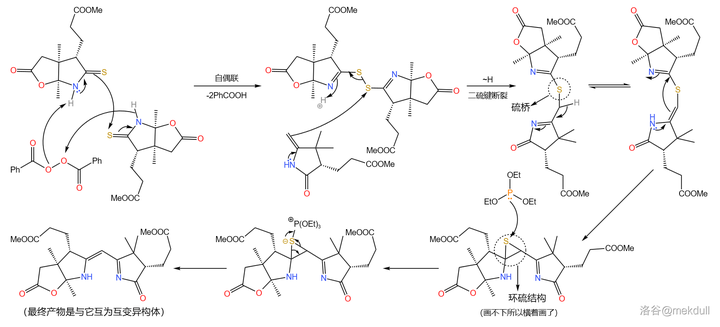
必須說,這個反應設計得非常巧妙,但它的 通用性並不好 ,因為受質之一的烯胺與亞胺是互變異構體,且一般 平衡偏向後者 。因此,有人對這個反應進行了改進,而稍後我們就會看到這種變異的 Eschenmoser 偶聯反應。
偶聯反應之後,距離完成 只差最後一步 了——將 14 號位的醯胺結構硫化。這一次,分子內多出了許多結構,為了保證它們不被破壞,課題組在多次實驗後選擇了在 甲基汞 離子(\ce{MeHg+} )催化下用 \ce{pS} 直接硫化的方案,並最終以高產率得到了目標產物:
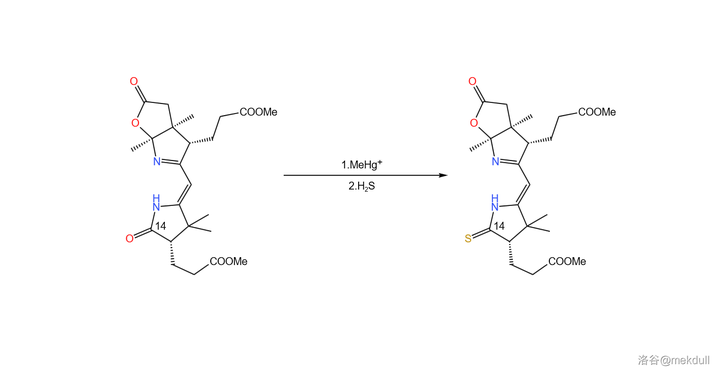
就這樣,右半部份「thiodextrolin 」的全合成也宣告成功。接下來,就該把它們拼起來了。
3.3 咕啉環的拼接與修飾
這一部份的工作是 兩個課題組各自完成 的,但篇幅所限,我們主要來講一講 Woodward 課題組設計的合成路線。(事實上,兩條路線的 大體思路是基本一致的 )
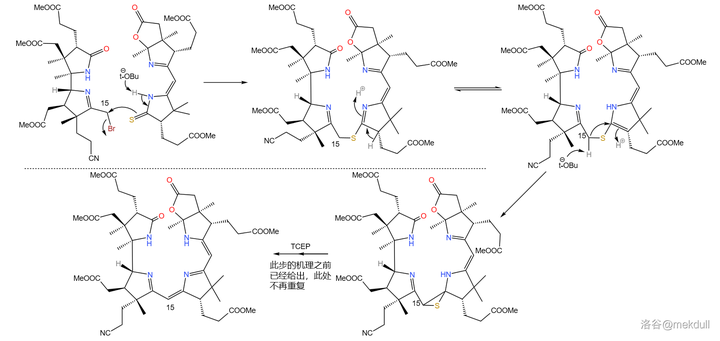
拿到了左右兩半後,首要的任務當然是將它們先拼在一起。Woodward 果斷采用了 Eschenmoser 偶聯的一種 變異反應 。這種變異將其中一種受質從烯胺變成了 活潑鹵代烴 ,從而使反應的通用性大大增強;利用它,就能輕松地在 15 號位上完成偶聯:
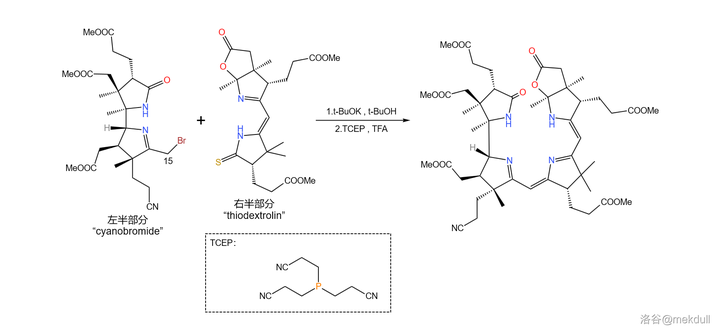
接著,在 4- 甲基吡啶 催化下用一定量的 \ce{P2S5} 處理之,4 號位的內醯胺和 7b 號位上活潑的內酯結構被硫化,分子中其他普通的酯基不受影響;隨後加入 Meerwin 鹽對 硫羰基 進行甲基化:
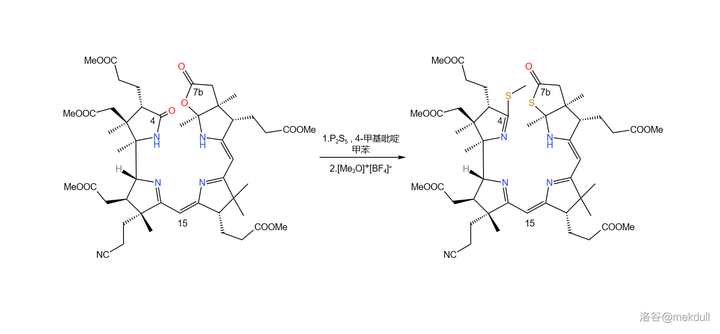
補充一句,\ce{P2S5} 在硫化酯基時一般先會生成 硫羰酯 ,也就是 \ce{-CSOR} 結構,但在堿性試劑作用下,硫羰酯會變成通常更穩定的 硫酯 (\ce{-COSR} )結構。對 7b 號位內酯結構的硫化就大致經歷了這一歷程。
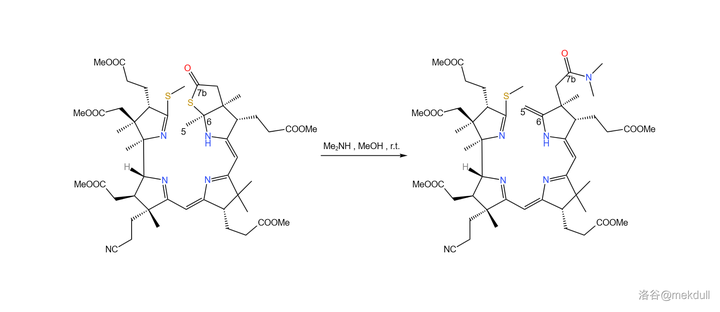
下一步,使用 二甲胺 (\ce{Me2NH} )開啟硫內酯環,得到 7b 號位的醯胺結構,同時在 5,6 號位上發生消去反應,生成雙鍵。這個反應看似簡單,但課題組卻花費了不少時間去 修正反應條件 ,才使反應的產率足夠令人滿意:
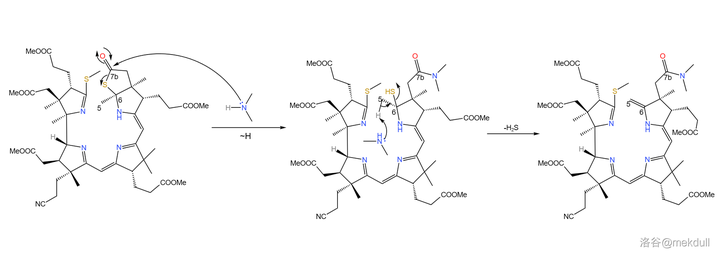
隨後,課題組打算引入中心配位的 \ce{Co} 原子。一開始,課題組並沒有預料到這一步的困難,但他們馬上就會知道了:\ce{Co} 是一種 極其有效的催化劑 ,可以 迅速催化該物質分解 ,讓前面的一切努力都變成白忙活。有人會問:為什麽一定要這麽著急地把 \ce{Co} 原子放進去呢?因為在下一步,我們將要進行 4 號位和 5 號位碳原子的偶聯。還是由於 空間位阻 ,此時 4 號和 5 號碳原子雖然在紙面上看起來很近,但實際上距離很遠——這就導致 分子內的偶聯反應難以進行 。下圖是由電腦渲染得到的,大家可以直觀感受一下兩者的距離:
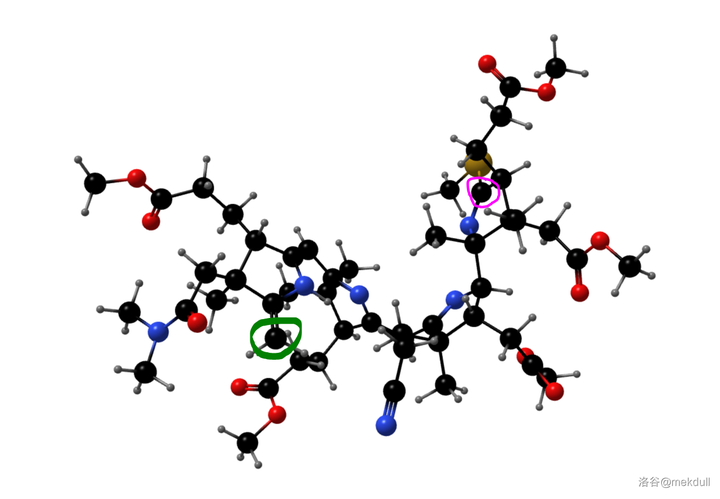
(上圖:目前我們手中化合物的空間結構,綠色圈出的是 5 號碳原子,粉色圈出的是 4 號碳原子)
如果此時我們成功地將中心的 \ce{Co} 原子塞進去,那麽 整個分子的空間結構都會因此改變 。4,5 兩個碳原子會被強行「拉攏」,從而使得它們之間的偶聯反應可以順利進行。想到這裏,Woodward 下定決心要攻克這道難題。它一定是有解的! 維生素B12就在那裏 ,它的存在,就是問題有解的最好證明!帶著這份信念,課題組花了 整整一年的時間 ,嘗試各種方法和反應條件,同時也嘗試揭秘 \ce{Co} 催化分解的機理。最終,他們找到了。
在最終的目標中,\ce{Co} 原子的氧化數應為 \ce{+III} ,但在幾百次實驗之後,課題組確信:正是 \ce{Co(III)} 破壞了分子的結構。所以,最終的解法就是:先在 \ce{THF} 中用 無水氯化鈷 (\ce{CoCl2} )處理,讓 \ce{Co(II)} 進入配位體系;隨後加入 \ce{KCN} 水溶液,利用 \ce{CN-} 離子強大的配位能力把 \ce{Co(II)} 「鎖」在分子的中心 ;等到萬事俱備了,再將 \ce{Co(II)} 用空氣氧化成 \ce{Co(III)} 。此時,就算是 \ce{Co(III)} 想搞破壞也不可能了:
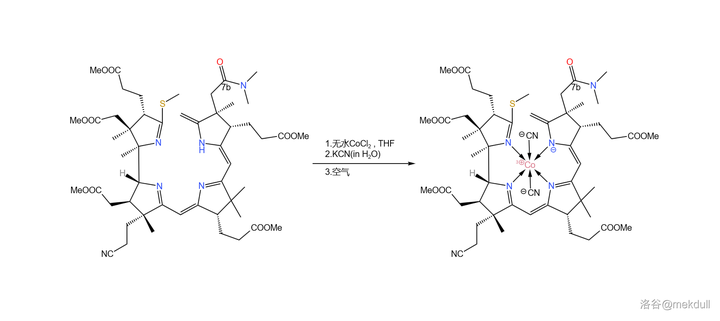
補充一句,此處的無水氯化鈷也 不是隨便選擇的 。很早之前就有人發現,\ce{Cl-} 和 \ce{I-} 似乎對於 鈷絡合物 的形成具有催化作用,雖然這種作用的機理尚不明確。到了這裏,如果不用無水鹵化物的話,那麽 \ce{Co(II)} 會很難進入配位體系,也就沒法進行下一步的反應了。
難題解決之後,後面的反應就如同預料一般順利了。在 \ce{DMAC} ( 二甲基乙醯胺 ,\ce{CpCON(Cp)2} )中用 有機堿 \ce{DBN} 進行催化,偶聯反應就可以高產率地進行:
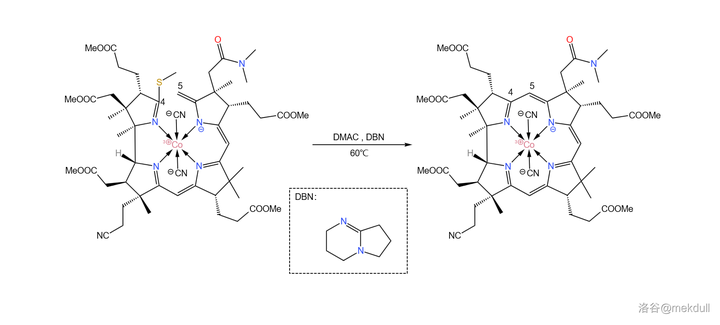
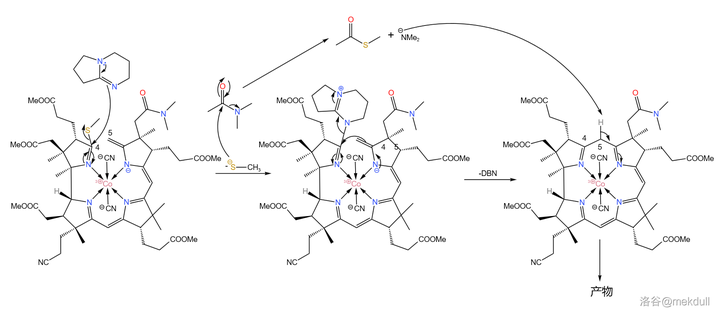
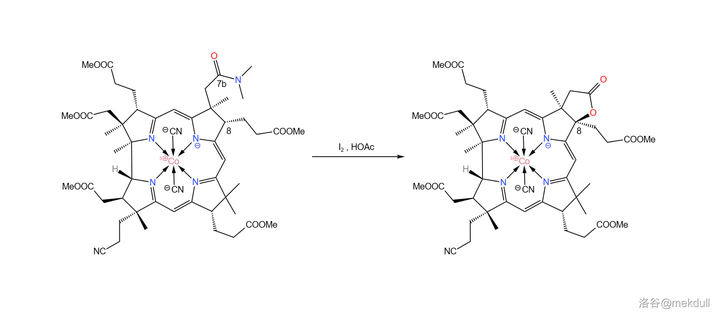
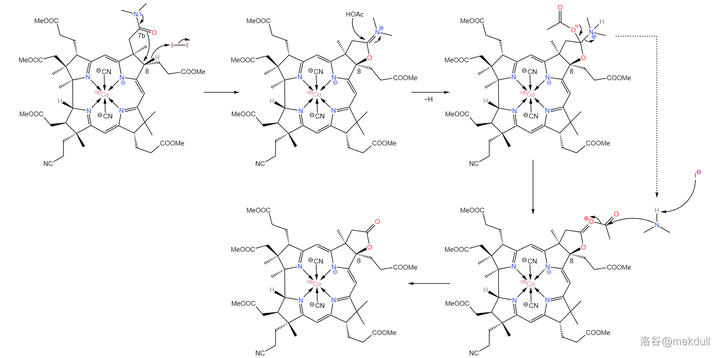
現在, 整個咕啉環的拼接已經宣告成功 ,接下來便是對其進行修飾。在 \ce{AcOH} 中用 碘單質 氧化該物質,8 號位的 \ce{C-H} 鍵斷裂,分子右上角的 7b 號位的醯胺結構變成內酯:
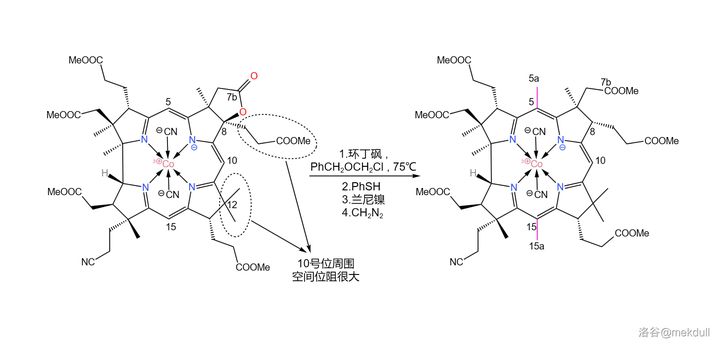
下一步,我們需要在 5 號位和 15 號位上各補上一個甲基(或許很多人都沒有註意到這兩個位置缺少一個甲基)。在 環丁碸 (溶劑)中,用 芐基氯甲基醚 (\ce{PhCpOCpCl} )可以直接活化 5,15 號位上的 \ce{C-H} 鍵並取代之;隨後加入 苯硫醇 (\ce{PhSH} ),5a,15a 號碳原子上的 芐氧基 (\ce{-OCpPh} )隨即被取代;接著,用 蘭尼鎳 (Raney~\ce{Ni} )進行 還原脫硫反應 ,7b 號位上的內酯結構也隨即被破壞,遊離出羧基;最後用 \ce{CpN2} 進行酯化,完成整個反應歷程。
有人可能會問,為什麽 10 號位上的氫原子沒有被取代呢?觀察分子的結構就能發現,10 號位周圍的空間 非常擁擠 ,附近的 8,12 號位的碳原子都是 完全取代 的(其實,上一個反應的目的就是將 8 號位完全取代,從而增大空間位阻),就像是一道屏障一般阻隔了試劑對 10 號位的進攻。這足以保證這個反應的選擇性:
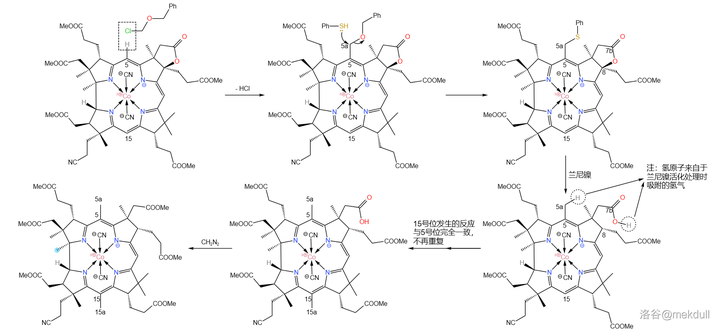
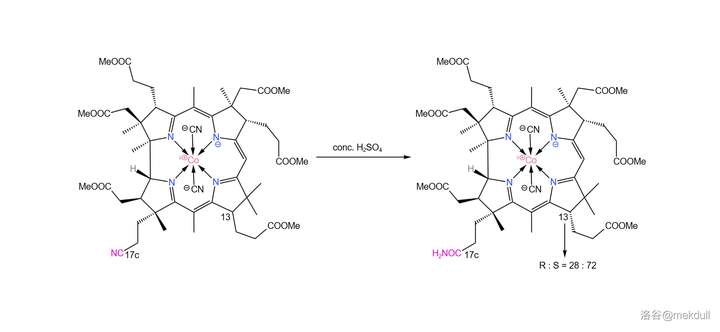
隨後,我們需要把 17c 號位的氰基(\ce{-C#N} )水解成羧基(\ce{-COOH} )。由於分子中 有眾多易水解的酯基 ,所以這並不是一項簡單的任務。課題組選擇先用濃硫酸處理該物質,將氰基 水解為末端醯胺 。沒錯,雖然一般濃硫酸是以「 脫水劑 」的身份出現的,但這裏它扮演了一個相反的角色。這裏的反應條件看似強烈,但主體的咕啉結構基本沒有遭到破壞。
除此之外,濃硫酸還起到了一個意料之外的作用。分子中的 13 號碳原子可以透過 互變異構 的方式轉變自己的構型,而濃硫酸恰好提供了這個條件。最終,13 號碳原子的 R:S 平衡為 28:72 (我們需要的是 S 型):
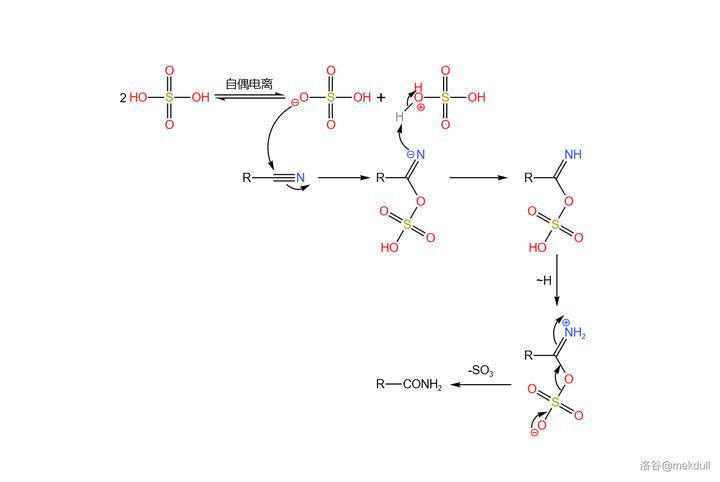
接下來就是考慮如何將醯胺結構水解成羧基。為了防止酯基被水解,課題組首先考慮了使用 亞硝酸酯 (通式 \ce{RONO} )作為水解試劑。遺憾的是,亞硝酸酯雖然出色地完成了水解任務,但它同時也會將分子的 10 號位 亞硝化 。為此,Woodward 課題組篩選了眾多 亞硝酸衍生物 ,但都無濟於事。最終,這一方案被放棄了。
在此關鍵時刻,隔壁的 Eschenmoser 課題組送來了助攻。簡單來說,他們發明了一種強大的 親電試劑 (在此就姑且稱之為 Eschenmoser 親電試劑吧),可以透過 氟硼酸銀 (\ce{AgBF4} )與一種 環己胺衍生物 反應生成。在非常弱的酸性條件下(可以用 酸堿緩沖體系 ),它就可以將醯胺轉化為 羥乙醛酯 。最後只需加入 \ce{Me2NH} ,就可以將活潑的羥乙醛酯轉化為羧酸:
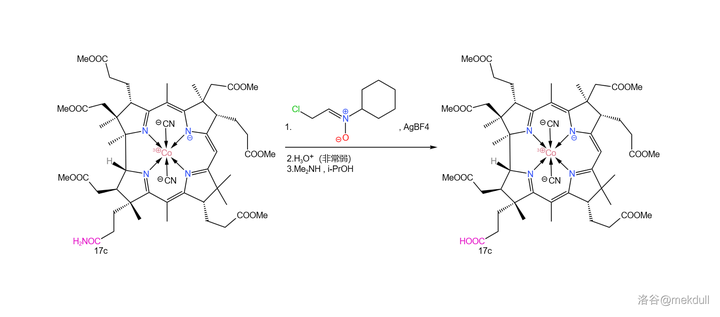
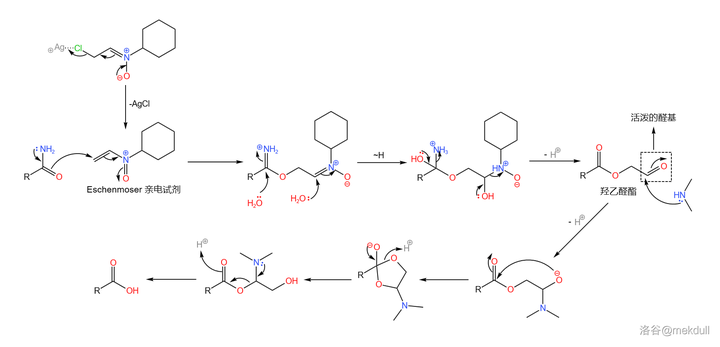
這個反應的設計極其巧妙,而且在面對如此復雜的受質時也可以給出超過 90\% 的產率——Woodward 評價這個反應「 狡猾而優雅 」。後續的研究證明,這個反應 對於幾乎所有醯胺都是有效的 ,不僅限於末端醯胺。如今,我們一般把它稱為 Eschenmoser 醯胺水解反應,在復雜天然產物的合成中常會用到。
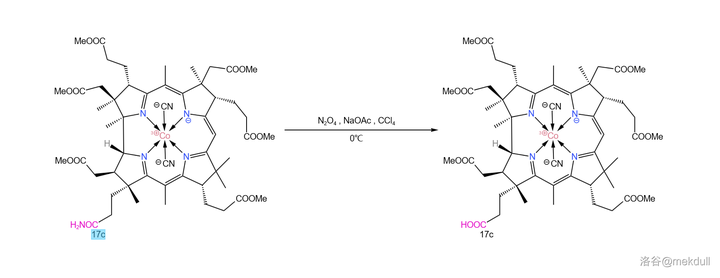
或許是不願落後於人,Woodward 課題組很快也發現了這個問題的另一種解法:在 四氯化碳 (\ce{CCl4} )中用 \ce{NaOAc} 和 四氧化二氮 (\ce{N2O4} )代替亞硝酸酯,就可以將醯胺有效水解,同時分子的 10 號位不再被亞硝化。反應產率 \ce{70\%-80\%} ,雖然比 Eschenmoser 的方法差了點,但如果從經濟上考慮,那 Woodward 的方法顯然是更優的:
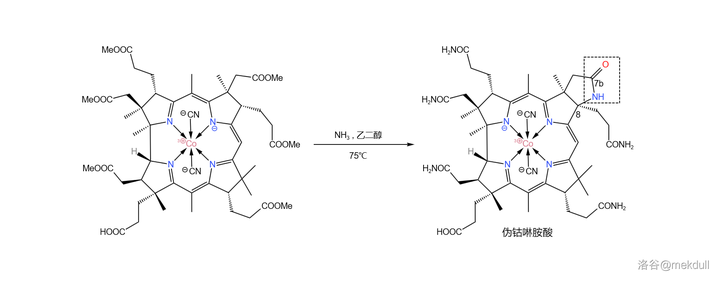
現在,距離成功合成鈷啉胺酸只差一步了:將分子中的六個酯基全部轉化為醯胺。在 75^{\circ}C 左右用氨(\ce{Np} )與 乙二醇 (\ce{HOCpCpOH} )大致 1:1 的混合物處理該物質,可以以高產率得到一種結晶。但令人大跌眼鏡的是, 它根本不是鈷啉胺酸 !
這種物質的 化學性質與鈷啉胺酸幾乎一致 ,且兩者具有基本相同的 紅外光譜 、 電子光譜 ,甚至於連 紙色譜 、 平面色譜 都完全無法區分二者。只有 高壓液相色譜 系統告訴我們:它們不一樣!如下圖所示,課題組得到的物質在化學式上比鈷啉胺酸少了兩個 \ce{H} 。在它的右上角,7b 號碳原子形成了內醯胺結構。課題組將這種物質稱為「 偽鈷啉胺酸 」(pseudocobyric~acid ):
為什麽分子會莫名其妙地去掉兩個 \ce{H} ?難道是 有空氣混進了反應體系 ?在反復檢查之後,課題組排除了這種可能。那它到底為什麽會被氧化呢?等等,分子中心還有一個配位的 \ce{Co} 原子!Woodward 猜想,中心配位的 \ce{Co(III)} 可以透過某種機制變成 \ce{Co(I)} 。由於 \ce{Co(I)} 具有很強的還原性,所以它會迫使分子會放出 \ce{p} ,並把自己變回 \ce{Co(III)} 。
所以,該怎麽解決這個問題?一開始,課題組希望 找到一種合適的還原劑 ,將偽鈷啉胺酸還原成鈷啉胺酸。他們搜尋了好幾個月,但根本沒有收獲。就在此時,他們意外地發現,只需將少量 銨鹽 (比如 氯化銨 \ce{NpCl} )加入反應體系,效果就立竿見影。偽鈷啉胺酸從產物中消失了,取而代之的是幾乎 100\% 產率的鈷啉胺酸:
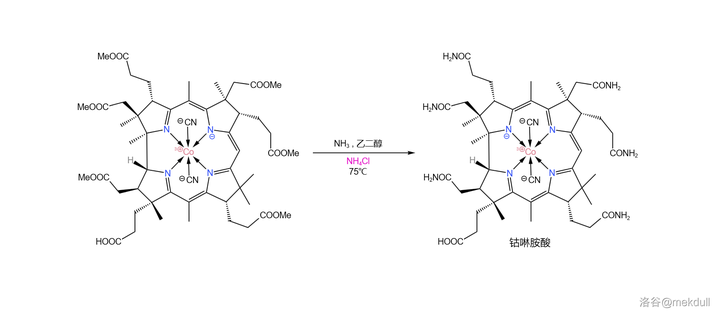
為什麽銨鹽會有這麽神奇的效果?Woodward 認為,生成偽鈷啉胺酸的機理中可能包含一個 醯胺負離子 中間體(\ce{-CONH^-} ),而 銨根離子 (\ce{Np+} )可以有效地 淬滅 醯胺負離子,從而抑制了偽鈷啉胺酸的生成。
由於沒有詳細研究,Woodward 並沒有在論文中給出生成偽鈷啉胺酸的詳細機理。但這或許已經不重要了,因為這一步的完成,標誌著 維生素B12的全合成宣告成功 。這座「有機合成界的珠穆朗瑪峰」,就這樣在人們的齊心協力之下被征服了。這一年是 1972 年。
但是,我們的旅程還沒有結束。畢竟,鈷啉胺酸距離維生素B12 還差一個結構類似於核苷酸的側鏈 ,那這個側鏈又應該如何合成呢?
3.4 核苷酸側鏈的合成與拼接
在概述中已經提到,這一部份的工作是德國化學家 Bernhauer~K. 等人在 1960 年完成的,所以對於 Woodward 來說,這部份的合成方法是現成的。但無論怎麽說,這條側鏈都是維生素B12的一部份,所以一篇完整的全合成介紹是少不了它的。
由於側鏈的結構 類似於核苷酸 ,所以 Bernhauer 的課題組也采用了類似於核苷酸的合成策略。但值得註意的是,這條側鏈的「 堿基 」並不是 \ce{A,C,G,T,U} 中的任何一個,而是一種 苯並咪唑 ; 磷酸基團 則是接在 核糖 結構的 3' 位,而不是 5' 位:
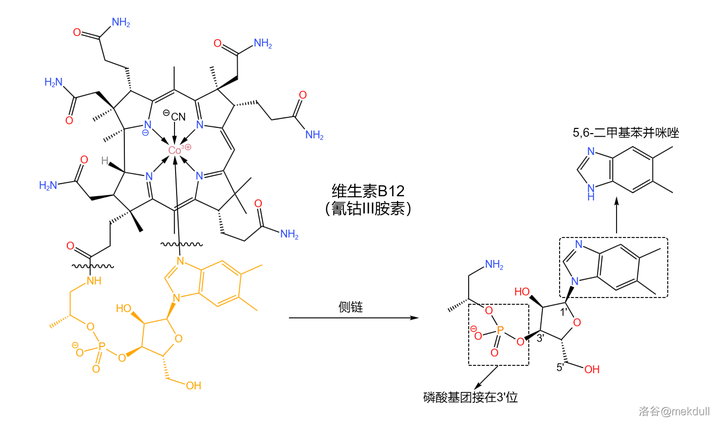
合成的起始物是一種有機染料工業的重要原料:4,5- 二甲基鄰苯二胺 。在 多聚磷酸 (或其他較強的酸)的作用下,它可以與 甲酸 縮合得到 5,6- 二甲基苯並咪唑:
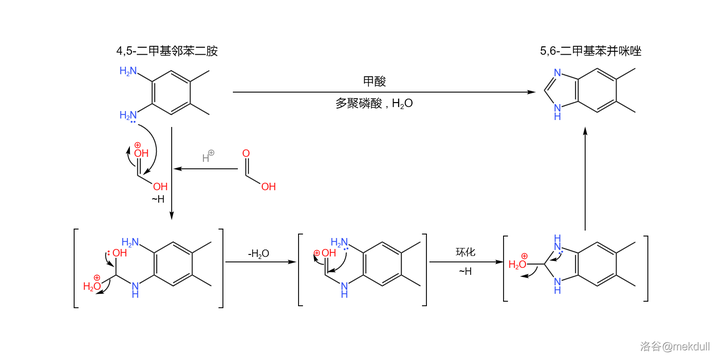
(註:較新的研究發現,上反應可以在 \ce{DMF} 中被 三甲基氯矽烷 (\ce{TMSCl} )催化,在此條件下產率可以達到 95\% 。上圖中展示的反應條件是上世紀使用的,產率相對較低)
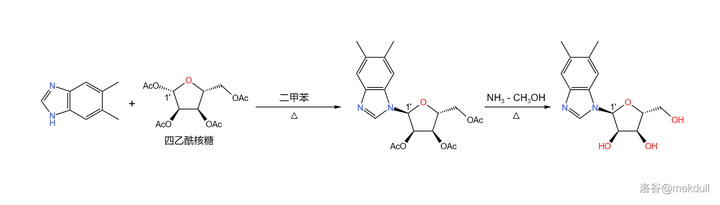
這樣一來,堿基就搞定了。隨後登場的是一種核糖的衍生物: 四乙酰核糖 ——它直到今天都是核苷酸合成中的重要試劑。在二甲苯中,它與剛才制得的 5,6- 二甲基苯並咪唑在 1' 號位發生 縮合反應 ;將反應的產物用 \ce{Np-CpOH} 處理,脫去多余的乙酰基後得到結構類似於 核苷 的物質:
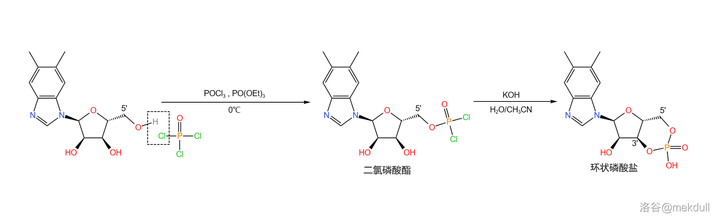
下一步,在低溫下用 三氯氧磷 (\ce{POCl3} )和 磷酸三乙酯 (\ce{PO(OEt)3} ,做溶劑)處理該物質,得到 5' 號位的 二氯磷酸酯 結構;隨後用強堿處理之,得到 3',5' 號位的 環狀磷酸鹽 :
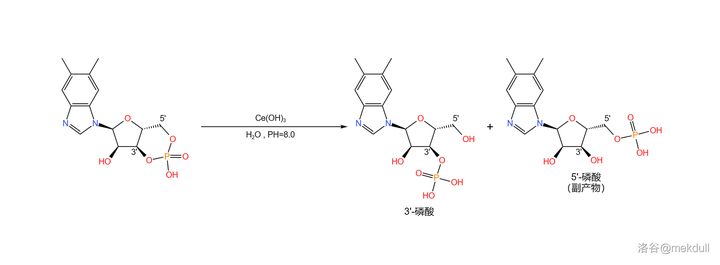
接著,在很弱的堿性(\text{PH}\approx8.0 )條件下,用 鈰離子 (\ce{Ce^3+} ,此處由於堿性太弱無法產生 氫氧化鈰 (\ce{Ce(OH)3} )沈澱;最近有研究指出,實際上起作用的是 \ce{Ce^3+} 在此條件下部份水解產生的 簇狀羥基配合物 )催化環狀磷酸鹽部份水解,可以得到 3' 號位的磷酸(副產 5' 位的磷酸):
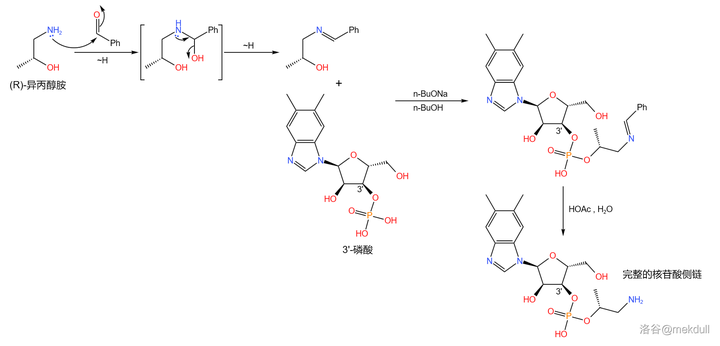
下一步,我們要把 3'- 磷酸與 異丙醇胺 (\ce{pNCpCHOHCp} ,有兩種 旋光異構體 ,此處使用 R- 異丙醇胺)縮合成磷酸酯。為了防止胺基的幹擾,課題組首先將其與 苯甲醛 (\ce{PhCHO} )反應,把胺基保護起來;隨後,在強堿 正丁醇鈉 (\ce{t-BuONa} )的作用下,兩者順利地發生縮合反應;反應結束後用乙酸水溶液脫去保護基,就能得到這條 完整的核苷酸側鏈 :
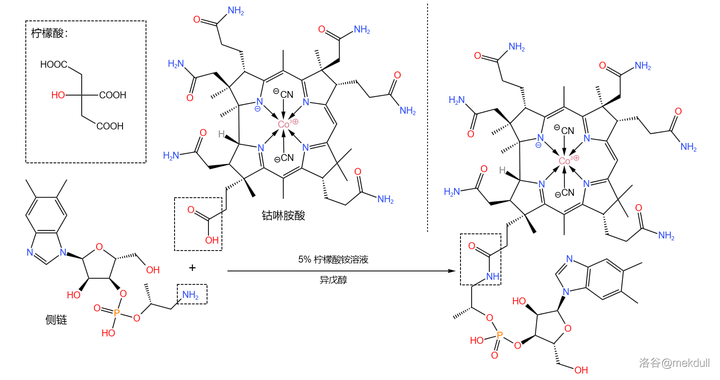
最後,我們需要 把這條側鏈「裝」到鈷啉胺酸上 。為此,課題組測試了多種反應條件,最終選擇使用 檸檬酸銨 溶液和 異戊醇 的混合物處理。二者順利地發生脫水縮合反應,以 92\% 的產率得到最終產物:
隨後,該物質在此條件下可以自發消去一個 \ce{HCN} 分子,而側鏈頂端的 \ce{N} 原子則會自動進入中心 \ce{Co} 原子的配位體系,從而得到成品維生素B12:
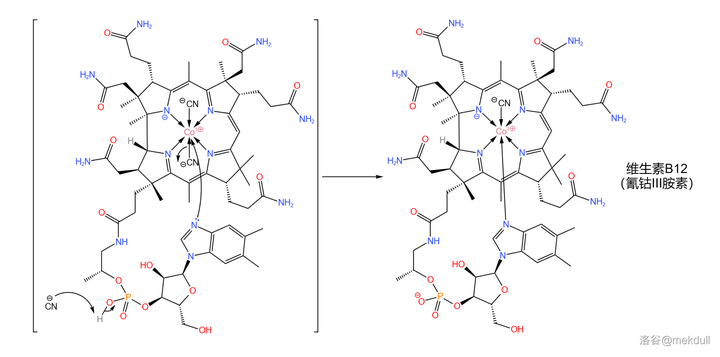
至此,那一抹亮麗的紅色終於出現在了人們眼前。
4.總結與後記
這或許是全網最完整、詳細的介紹維生素B12全合成的中文文章了。全文字數超過了一萬五千,也有八十多張配圖。如果喜歡還請多多支持,謝謝!(上次說的關於牛胰島素全合成的解析已經在寫了,但由於資料和時間問題,我也不敢說什麽時候可以寫完)
維生素B12的全合成是有機合成界前所未有的壯舉 。毫不誇張的說,這項工作可以成為劃分「 近現代 」有機化學和「 當代 」有機化學的分界線。它的意義遠不止 拓展了有機合成復雜性的界限 ,更重要的是,它的成功沈重打擊了幾百年來「 化學局限論 」的思想,讓人們開始相信: 化學真的可以為人類創造一個新的世界 。
即使拋開思想上的啟迪,這項工作 在實際上的意義也不遑多讓 。在此次全合成中首次亮相的 Eschenmoser 偶聯反應已經成為 構築碳碳鍵的重要手段 ,在許多藥品的工業化合成中得到套用;Bernhauer~K. 等人合成側鏈的方法在之後的歲月中被不斷改進,衍生出了眾多重要的 核苷酸化學合成法 ,為今日 腺苷 、 肌苷 、\ce{ADP} 、\ce{ATP} 等生物分子的大規模合成打下了基礎,也成為了 遺傳物質化學合成 的支點之一;咕啉環的人工合成法指導了人們探尋生物體內咕啉結構的構建,並最終將其 合理化 ,闡明了生物合成維生素B12的機理;Woodward 團隊在合成過程中闡明了 互變異構導致的構型翻轉 ,再一次提升了人類對於手性的認識,指導著後世幾乎所有的手性合成方法;合成過程中發現的 \ce{Co} 元素的顯著催化作用,到今天已經發展成為有機合成的一種強大策略,諸如 \ce{Co} 催化的 偶聯反應、環加成反應、消去反應 等令人眼花繚亂;合成過程中,Woodward 和他的學生 Hoffmann 發現了 \ce{D-A} 反應在不同條件下的立體選擇性,兩人進而將這些規律總結、歸納,最終提出了名震整個有機化學界的 軌域對稱守恒原理 ,也叫 Woodward-Hoffmann 規則——這被認為是近年來 化學理論方面的最大成就 。
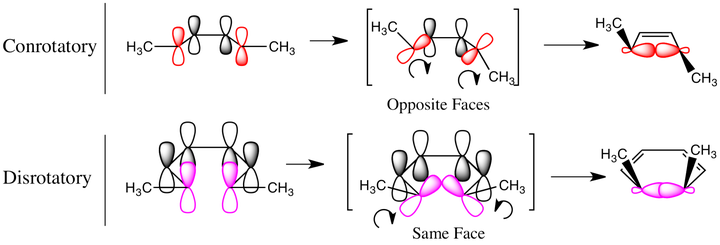
(上圖:軌域對稱守恒原理的簡單圖示)
在科學家們的努力之下,1993 年,維生素B12的 生物合成機制 被基本闡明。在此之後,人們開發出了維生素B12的 生物合成技術 ,這才有了今天能夠直接在藥店裏買到的維生素B12藥片。然而,誰能想到,在這種不起眼的廉價藥品背後,暗藏著 150 余年來無數科學家為之不懈奮鬥的史詩。
1979 年,積勞成疾的伍德沃德因心臟病突發去世,享年 62 歲。他在去世的前一天仍念念不忘那還未完成的 吉貝素 (gibberellin )全合成。最終,他的學生帶領著剩下的課題組成員完成了這項工作;而在他去世 15 年後,他的另一位學生 Y.Kishi 將完成有機合成界「 新的珠穆朗瑪峰 」—— 巖沙海葵毒素 (palytoxin )的全合成。如果伍德沃德能看到,想必他一定會倍感欣慰吧。
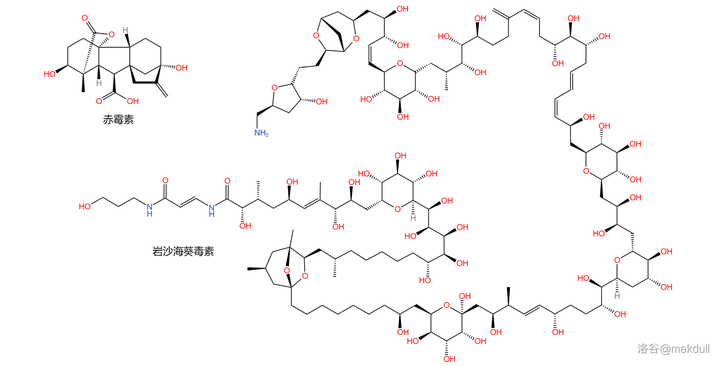
(超連結:關於巖沙海葵毒素全合成的詳細解析)
相比於伍德沃德,另一位主角 Eschenmoser 教授並沒有在這次偉大的工作中收獲多少名聲,如今或許也沒有多少人記得他的團隊也是維生素B12全合成的重要參與者。更鮮有人知的是,在完成這項工作之後,他選擇 以維生素B12為切入點 ,研究兩個根本看不到終點和希望的課題: 生命的化學起源 和 演化對於天然產物的構建 。盡管這註定是一條無比艱難的路,但他仍然義無反顧地走了下去。
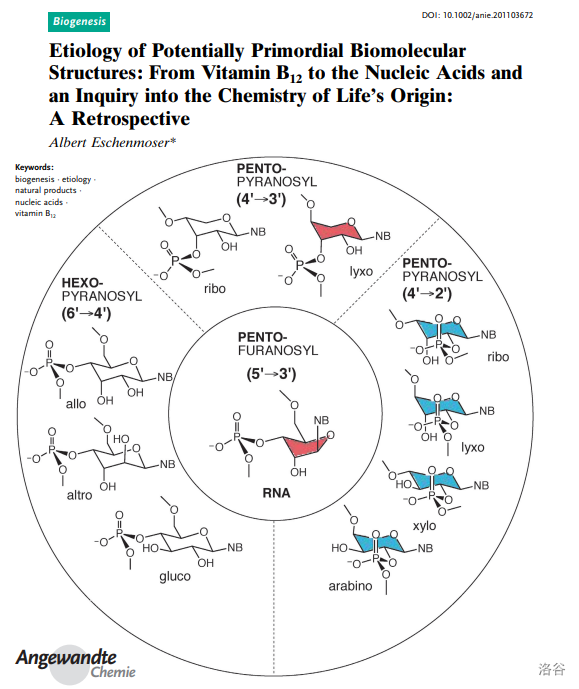
(上圖:【潛在原始生物分子結構的病原學:從維生素B12到核酸,關於生命化學起源的探討】論文影,A.~Eschenmoser ,2011 )
「我們可能永遠也無從知曉」,這句老生常談的話只會引導我們放棄尋找生命起源問題的努力······但對大自然創造生命之原理的探索永遠不會真正結束,因為 這是我們在探索我們自己的起源,探索我們自己的曾經 。 ——【潛在原始生物分子結構的病原學:從維生素B12到核酸,關於生命化學起源的探討】,A.~Eschenmoser ,2011A.~Eschenmoser 於 2023 年去世,享年 98 歲。顯然,直到去世他也沒有找到這兩個終極問題的答案。但是,他的學生們接替了他,在這條看不到盡頭的道路上繼續前行。
伍德沃德曾經說過一句流傳很廣的話: 合成,是一門藝術 。但我認為,不光是有機合成, 任何科學探索,都是偉大的藝術 。
而藝術,需要人們不斷地去傳承與創新。
5.參考文獻
[1] :Woodward R B. The total synthesis of vitamin B12[J]. Pure and Applied Chemistry Eighth, 1973, 33(1): 145-178.
[2] :Eschenmoser A, Wintner C E. Natural Product Synthesis and Vitamin B12: Total synthesis of vitamin B12 provided a framework for exploration in several areas of organic chemistry[J]. Science, 1977, 196(4297): 1410-1420.
[3] :Woodward R B. Recent advances in the chemistry of natural products[J]. Pure and Applied Chemistry, 1968, 17(3-4): 519-547.
[4] :Eschenmoser A. Studies on organic synthesis[C]//XXIIIrd International Congress of Pure and Applied Chemistry: special lectures presented at Boston, USA, 26-30 July 1971. Butterworths, 1971, 2: 69-106.
[5] :Friedrich W, Gross G, Bernhauer K, et al. Synthesen auf dem Vitamin‐B12‐Gebiet. 4. Mitteilung Partialsynthese von Vitamin B12[J]. Helvetica Chimica Acta, 1960, 43(3): 704-712.
[6] :Eschenmoser A. Vitamin B12: experiments concerning the origin of its molecular structure[J]. Angewandte Chemie International Edition in English, 1988, 27(1): 5-39.
[7] :Eschenmoser A. Etiology of potentially primordial biomolecular structures: from vitamin B12 to the nucleic acids and an inquiry into the chemistry of life’s origin: a retrospective[J]. Angewandte Chemie International Edition, 2011, 50(52): 12412-12472.
[8] :Friedrich W, Bernhauer K. Zur Konstitution des Vitamin B12-Faktors III[J]. Zeitschrift für Naturforschung B, 1954, 9(11): 685-697.
[9] :Woodward R B, Hoffmann R. Stereochemistry of electrocyclic reactions [J]. J Am Chem Soc, 1965, 87(2): 395-397.
[10] :Woodward R B, Hoffmann R. Conservation of orbital symmetry [J]. Acc Chem Res, 1968, 1(1): 17-22.
[11] :Zimmerman H E. A mechanistic analysis of the Birch reduction[J]. Accounts of chemical research, 2012, 45(2): 164-170.
[12] :KARUVALAM R, HARIDAS K, SHETTY S. Trimethylsilyl chloride catalyzed synthesis of substituted benzimidazoles using two phase system under microwave conditions, and their antimicrobial studies[J]. Journal of the Chilean Chemical Society, 2012, 57(2): 1122-1125.
[13] :Blanche F, Cameron B, Crouzet J, et al. Vitamin B12: How the problem of its biosynthesis was solved [J]. Angew Chem Int Ed, 1995, 34(4): 383-411.











