學會動態
2024年5月27日,Nature Biotechnology雜誌線上發表了由 CAAI理事長、清華大學戴瓊海院士,以及清華大學吳嘉敏副教授、俞立教授與浙江荷湖科技有限公司合作完成 的題為Long-term intravital subcellular imaging with confocal scanning light-field microscopy的研究論文。
團隊歷經三年多的技術攻關和落地轉化,研制了 新一代的共聚焦掃描光場顯微鏡(csLFM) ,為科學家在活體復雜環境中獲得更真實、可靠的細胞及亞細胞結構間相互作用資訊提供前所未有的研究工具,支撐腦科學、免疫學、病理學等基礎學科產生重大突破。
轉自 BioArt
越來越多的研究發現體外與活體環境間的巨大差異會顯著影響細胞的功能與表型。大量生理與病理狀態下不同類別細胞間的互動作用難以在體外復現。因此,在哺乳動物活體原位對細胞及亞細胞的高速變化進行長時程觀測變得尤為重要。然而,目前常用的活體顯微成像技術如轉盤共焦顯微鏡(spinning disk confocal microscope,SDCM)和雙光子顯微鏡(two-photon microscopy),雖然透過共聚焦探測和非線性激發的方式有效去除了背景熒光幹擾,但仍然面臨三維成像速度慢,光毒性大,組織像差引起的分辨率低等重要問題,難以滿足日益增長的活體觀測需求。清華大學團隊於2021年提出掃描光場顯微鏡(scanning light-field microscopy, sLFM)(詳見BioArt報道:Cell突破|戴瓊海團隊以前所未有的時空分辨率進行哺乳動物活體長時程觀測) 【1】 ,能夠以相機幀率的超高速實作三維高分辨率觀測,並將光毒性降低了三個數量級,為活體多細胞間互動研究開啟了大門,但在一些復雜組織和樣本中仍然面臨強背景熒光幹擾,相比於共聚焦探測損失了成像對比度。
針對這一難題,2024年5月27日, Nature Biotechnology 雜誌線上發表了清華大學 戴瓊海 、 吳嘉敏 、 俞立 與浙江荷湖科技有限公司合作完成的題為 Long-term intravital subcellular imaging with confocal scanning light-field microscopy 的研究論文 【2】 。團隊歷經三年多的技術攻關和落地轉化,在掃描光場顯微鏡的基礎上引入了線掃描共聚焦模組,配合全新的三維重建演算法,研制了新一代的共聚焦掃描光場顯微鏡(csLFM),兼具兩者的效能優勢。csLFM擁有跟共聚焦顯微鏡一致的光學層析能力,即使在深層組織或密集標記的熒光樣本中依然能保持高對比度,同時三維成像速度相比轉盤共聚焦顯微鏡SDCM提高了100倍,光毒性降低了130倍,打破了並列度與保真度間的矛盾。csLFM將替代傳統共聚焦顯微鏡,為科學家在活體復雜環境中獲得更真實、可靠的細胞及亞細胞結構間相互作用資訊提供前所未有的研究工具,支撐腦科學、免疫學、病理學等基礎學科產生重大突破。

團隊前期開發的掃描光場顯微鏡已經在高速亞細胞分辨率長時程三維觀測上具備顯著優勢,如何兼具光學層析能力是進一步提高其在多樣性生命科學與醫學套用中保持穩定魯棒的成像質素和實用性的關鍵所在。如圖1所示,共聚焦掃描光場顯微鏡csLFM巧妙地透過軸向拓展的線掃照明與相機本身的捲動快門將共聚焦策略整合到掃描光場顯微鏡sLFM中。由於掃描光場顯微鏡天然的三維感知能力,無需非常小的狹縫或者小孔去除背景熒光,軸向拓展的線掃照明能夠在不損失三維光效率和三維成像速度的前提下對有效三維成像範圍外的背景熒光進行特異性的去除,將影像的信背比 (signal-to-background ratio, SBR) 提升了12 dB,具備與共聚焦顯微鏡一致的光學層析能力,並在數碼自適應光學的支撐下在復雜環境中保持了近繞射極限的三維高分辨率,精確捕捉胞器等亞細胞結構。
脾臟在免疫功能方面扮演著重要角色,其含有大量的免疫細胞和多種免疫分子。但因組織密集、強背景熒光以及對光損傷的敏感性,脾臟中細胞和亞細胞水平的成像極具挑戰性。研究人員憑借csLFM出色的光學層析效能和極低的光毒性,在 國際上首次實作了脾臟內免疫微環境連續數小時的毫秒級高速三維高分辨率觀測,並精細刻畫了免疫系統在自然狀態下如何協同工作 。研究人員意外地觀察到NK細胞透過收縮絲體與巨噬細胞粘附,並在巨噬細胞內定向產生遷移體,該遷移體傳遞現象也是首次在除了嗜中性球之外的其他免疫細胞中觀察到,提示遷移體傳遞可能是一種增強先天適應力免疫監視的訊號協同機制。更進一步地,csLFM作為一個通用的活體成像框架,在有效去除背景熒光及其帶來的光子雜訊後,能夠精細地分辨微小的胞器結構。例如, 尺寸僅為50-250nm的收縮絲體,其在小鼠體內的生成過程清晰地被csLFM動態呈現。
圖1 | 活體小鼠脾臟體內遷移體傳遞過程的高速高分辨高保真三維成像
圖2 | 活體小鼠體內收縮絲體(50-250nm)的三維快速生成過程監控
方向選擇性在視覺神經編碼過程中起關鍵作用。研究人員利用csLFM記錄了動態光柵刺激下小鼠初級視覺皮層多個神經元的鈣活動,來評估對視覺刺激有反應的神經元的調諧特性。盡管掃描光場顯微鏡相比於傳統寬場顯微鏡已經顯著去除了背景訊號的幹擾,但仍然有一些弱訊號被淹沒於巨大的背景訊號中,特別在密集神經元標記的狀態下,共聚焦掃描光場顯微鏡極大地削弱了大腦組織散射和密集熒光標記帶來的背景串擾。定量結果表明,csLFM在皮層200-300微米的深度中,獲得的神經元方向選擇性指數(OSI)達52%,與雙光子顯微鏡的成像效能相媲美並具備更高的空間分辨率。csLFM有望廣泛套用於腦科學研究中,研究神經元與不同類別細胞間的動態互動過程。
跨膜電壓指示劑可以對單個神經元內毫秒級響應進行檢測,為在體大範圍電生理記錄提供了可能。然而,該技術也對顯微成像技術也提出了巨大的挑戰。csLFM在國際上首次實作對一個清醒的果蠅大腦中幾乎所有的多巴胺能神經元進行大規模高保真訊號記錄,成像深度達100微米,速度高達為150幀/秒。對比數據表明,csLFM辨識的神經尖峰數量比sLFM增加了近3倍和脈沖振幅增強了1.5倍。此外,csLFM還可以將sLFM中被背景淹沒的弱電壓訊號高保真地辨識出來。該方法有力推進了電壓指示劑在神經科學中的套用,助力對神經環路功能和機制的精細化認識,對由神經環路發育異常引起的相關疾病診斷和治療有重大意義。
據悉,該突破性技術已落地轉化為顯微儀器產品SLiM2000。這也是研究團隊產學研同步推進的首次嘗試,在原理技術發表的同時推出量產的商業化系統。為了彌合學術研究原理樣機與商用儀器之間的鴻溝,滿足基礎研究對先進儀器的迫切需求,過去三年多的時間裏,SLiM2000理論技術研究與工程化產品研發雙管齊下。 SLiM2000儀器產品已於近日與學術論文同時正式釋出 (http://www.hehutek.com/cn/product/slim2000)。該產品在分辨率和光學層析效能與轉盤共聚焦顯微鏡保持一致的情況下,支持高達每秒150幀的亞細胞分辨率高保真三維成像,三維成像速度提升100倍以上。同時還配置有自動化的電動位移台,搭配客製化的樣品介面卡,實作即時自動聚焦、自動追焦、即時渲染,借助人工智能分析,以獲取更快的結果跟蹤和更為深入的數據分析,並能直接與團隊前期開發的去噪軟件等相容。助力高速神經成像、免疫微環境觀測等大規模活體細胞間相互作用的研究。

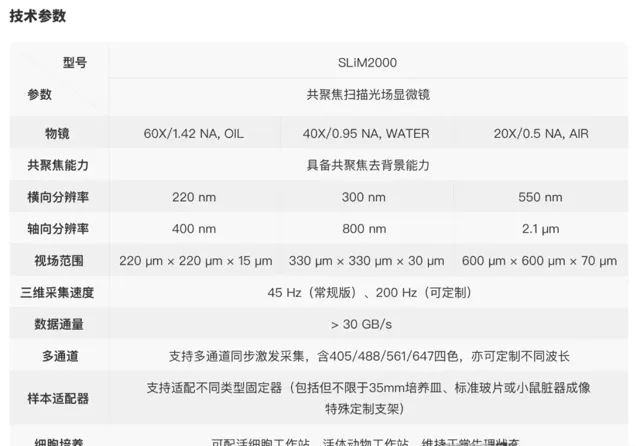
圖3 | 自主研制的SLiM2000共聚焦掃描光場顯微成像儀器和技術參數
清華大學自動化系博士後盧誌、博士生左思清、生命學院博士生史明慧為該論文的共同第一作者,清華大學自動化系、北京資訊科學與技術國家研究中心、腦與認知科學研究院、清華-IDG/麥戈文腦科學研究院戴瓊海教授,吳嘉敏副教授,生命學院俞立教授為論文共同通訊作者。
原文連結:
制版人:十一
參考文獻
1. Wu, J. et al. Iterative tomography with digital adaptive optics permits hour-long intravital observation of 3D subcellular dynamics at millisecond scale. Cell 184, 3318-3332 (2021).
2. Lu, Z. et al . Long-term intravital subcellular imaging with confocal scanning light-field microscopy. Nature Biotechnology (2024). https://doi.org/10.1038/s41587-024-02249-5











