在肠道的微观世界里,一场不为人知的战争正在上演。最新研究发现,产气荚膜梭菌(Clostridium perfringens)还可以通过破坏肠道屏障的关键组成部分——紧密连接蛋白,进而破坏肠上皮细胞,导致家禽营养消化吸收不良,甚至引发更严重的肠道疾病。这一过程,就像是敌人找到了城墙的弱点,开始有计划地破坏防御。

文| 郝明飞
建明(中国)科技有限公司
01
肠道屏障的构成
众所周知,肠道健康是动物健康的基础。
一个健全的肠道屏障由微生物屏障、化学屏障、物理屏障、免疫屏障组成(图1),这些屏障可以防止病原体和有害物质的侵入,还能促进有益物质的吸收。
因此,保持肠道屏障的完整性对于确保家禽的健康至关重要。
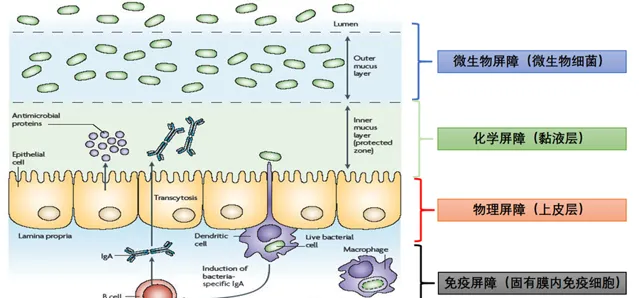
图1.肠道屏障的构成(Belkaid, Y and T. Hand.2014)
1
物理屏障:即肠道上皮层,构成肠道屏障的物理基础,通过细胞间的多种连接方式,形成选择性通透的屏障。
上皮细胞间的连接包括紧密连接、黏着连接、桥粒和间隙连接。
紧密连接是由多种蛋白质组成,如闭合蛋白和粘连蛋白,它们构成了肠道屏障,防止有害物质和病原体的入侵,并控制物质的跨细胞运输。
2
化学屏障:即黏液层,由肠道上皮细胞分泌,形成保护性的凝胶状层,阻止病原体和有害物质接触上皮细胞。
3
微生物屏障:即肠道微生物群,肠道内存在着数以万亿计的微生物种类,这些微生物与宿主共同维持着肠道屏障的完整性和功能。
4
免疫屏障:即免疫细胞,如树突细胞、巨噬细胞和T细胞等,它们在肠道黏膜表面监控病原体,参与免疫反应。
02
紧密连接的组成及生物学功能
紧密连接(Tight Junction,TJ)主要位于肠上皮细胞的顶端和边缘处,其结构是由闭合蛋白(Claudins)、咬合蛋白(Occludin)、连接黏附分子(JAMs)、闭合小环蛋白(ZOs)及肌动蛋白(Actin)细胞骨架等共同构成的蛋白复合物(图2)。
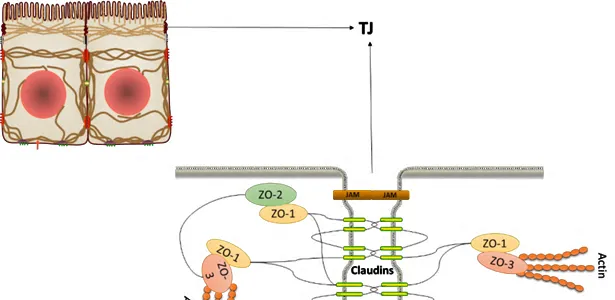
图2.紧密连接蛋白结构示意图(Hirase T,et al. 2001)
Claudins是TJ的主要结构和功能蛋白,可双重调节上皮屏障的密封性和渗透性,即能封闭细胞间隙,加固TJ屏障,又可负责形成细胞旁路,增加细胞旁渗透性(Milatzs,2010)。
它有4个疏水的跨膜区、2个细胞外环形结构及位于胞质中的羧基端和氨基端。
胞质中羧基端上具有潜在的磷酸化位点,磷酸化对紧密连接蛋白在紧密连接复合体中的定位具有调节作用。
紧密连接蛋白的主要功能(Bischoff S C, et al. 2014):
① 调节细胞通透性。
选择性通过离子和可溶性小分子物质,并限制大分子物质和外来病原微生物通过。
② 维持细胞极性。
通过限制细胞间脂质和完整膜蛋白的自由扩散来维持细胞不同液体之间的极性。
紧密连接蛋白是肠道屏障功能的重要组成部分,它的完整性关系到整个肠道屏障功能的维持。
在外来微生物入侵肠道时,TJ可以将其阻止在肠道的黏液层,防止微生物进入血液循环引发肠道疾病。
紧密连接蛋白的完整性受损,会导致肠道屏障功能受损,增加病原体侵入的风险。
03
产气荚膜梭菌通过利用紧密连接
破坏肠上皮细胞的主要机制
产气荚膜梭菌能够产生20多种毒素和酶,其中包括主要的致病毒素如α,β,ε和ι毒素及肠毒素(CPE)和坏死性肠炎B样毒素(NetB)。
这些毒素可以破坏肠上皮细胞,引起炎症和组织损伤。
病原体可以通过不同的机制破坏紧密连接的屏障功能,包括直接重组或降解特定的TJ蛋白,重组细胞骨架,激活宿主细胞内的信号通路。(Fasano, 2004)
α毒素(磷脂酶C)和ε毒素,通过激活磷脂酶破坏肠黏膜屏障,进而增加肠通透性。
β毒素(胶原蛋白酶)等酶类可以降解细胞外基质和紧密连接蛋白,破坏肠上皮屏障的完整性。(Wageha ,et al. 2017)
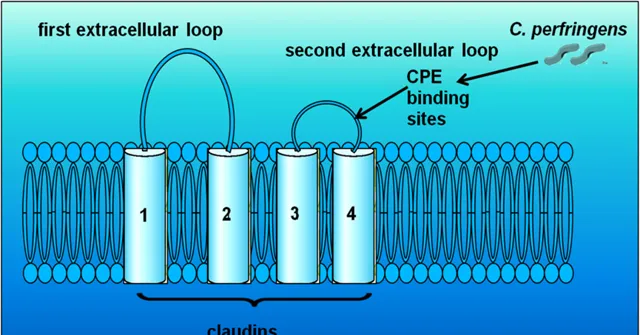
图3. claudin-3和claudin-4是产气荚膜梭菌肠毒素(CPE)的结合位点(Günzel,et al. 2013)
产气荚膜梭菌肠毒素(CPE)是一种细胞毒性、形成孔洞的毒素,它可直接利用紧密连接蛋白claudin-3和claudin-4作为细胞表面受体进行附着(图3),形成CPE-claudin复合物,之后迅速寡聚成一个大的复合物,在宿主细胞膜上形成β-桶状孔,使Ca2+快速流入,导致紧密连接的解体和上皮细胞层之间的细胞间隙通透性增加,最终导致细胞死亡。(Wageha ,et al. 2017)
参考文献:
1、Wageha ,et al.Enteric Pathogens and Their Toxin-Induced Disruption of the Intestinal Barrier through Alteration of Tight Junctions in Chickens;
2、Bischoff S C, Barbara G, Buurman W, et al. Intestinal permeability - a new target for disease
prevention and therapy;
3、Fasano, A.; Nataro, J.P. Intestinal epithelial tight junctions as targets for enteric bacteria-derived toxins;
4、 Milats,et al. Claudin- 3 acts as a sealing component of the tight junction for ions of ei⁃ ther charge and uncharged solutes;
5、Günzel, D.; Yu, A.S. Claudins and the modulation of tight junction permeability;
6、Hirase T, Kawashima S, Wong E Y M, et al. Regulation of tight junction permeability and occludin phosphorylation by RhoA-p160ROCK-dependent and -independent mechanisms;
7、Belkaid, Y and T. Hand. Role of the Microbiota in Immunity and Inflammation;

©Kemin Industries, Inc. and its group of companies 2024. All rights reserved. ®™Trademarks of Kemin Industries, Inc., U.S.A.
Certain statements may not be applicable in all geographical regions. Product labeling and associated claims may differ based upon government requirements.
如您有关于建明产品与服务的问询,
或发送邮件至:[email protected]
感谢关注与支持!












