原創 圖靈基因 圖靈基因 2022-06-07 07:03 發表於江蘇
收錄於合集#前沿分子生物學機制
臨床試驗失敗導致科學突破的情況並不常見。但是,當英國的患者在癌癥免疫治療II期試驗中開始出現不良副作用時,La Jolla免疫研究所(LJI)癌癥免疫治療中心和利物浦大學的研究人員回顧了數據,並對患者樣本進行了研究,以確定可能的原因。
他們最新報告的研究結果為解釋為什麽許多免疫療法會引發危險的副作用——免疫相關不良事件(irAEs)提供了重要線索,——該團隊隨後在小鼠模型中進行的實驗表明,在治療實體瘤患者時,可能有一種更好的免疫療法給藥策略,可以避免這些不良副作用。
「這項工作表明了從早期臨床試驗中學習的重要性。」La Jolla免疫學研究所教授Pandurangan Vijayanand醫學博士說,他與利物浦大學教授、Clatterbridge癌癥中心NHS信托基金會教授、LJI副教授Christian H. Ottensmeier醫學博士共同領導了這項研究。「這項研究說明了如何從臨床研究轉到小鼠研究,以了解這些患者的毒性背後的原因。」LJI教授Mitchell Kronenberg博士補充道,他的實驗室領導了這項新研究的大部份小鼠模型工作。
他們的研究結果發表在【Nature】雜誌上的一篇題為「Intermittent PI3Kδ inhibition sustains anti-tumor immunity and curbs irAEs」的文章中。

作者解釋說,磷酸肌醇3-激酶δ(PI3Kδ)在淋巴細胞中起關鍵作用,靶向這種PI3K的抑制劑已被批準用於治療B細胞惡性腫瘤。但是,雖然在實體瘤小鼠模型中的研究表明,PI3Kδ抑制劑(PI3Kδi)可以誘導抗腫瘤免疫,「……其對人類實體瘤的影響尚不清楚。」
Vijayanand和Ottensmeier都是醫學科學家,Ottensmeier是治療實體瘤患者的主治腫瘤學家。在過去的十年裏,由於免疫療法的進步,他看到越來越多的患者茁壯成長,免疫療法與免疫系統一起殺死癌癥。
「在腫瘤學領域,免疫療法已經徹底改變了我們對治療的看法。」研究人員說,「我們甚至可以對轉移性和擴散性疾病的患者進行免疫治療,然後僅僅三年後就揮手告別,並告訴他們,他們的癌癥已經治愈。這是一個驚人的變化。」
不幸的是,在接受免疫治療的實體癌患者中,只有大約20%-30%的患者會進入長期緩解期。有些人在免疫治療後看不到任何變化,但有些人在治療期間肺部、腸道甚至皮膚出現嚴重問題。這些副作用可能會使人虛弱,甚至致命,這些患者被迫停止接受免疫治療。
作者接著說,PI3K抑制劑最初被認為主要針對癌細胞固有的PI3K活性,這是在B細胞惡性腫瘤中測試針對富含白細胞的PI3Kδ抑制劑的基本原理。「然而,隨後的研究表明,PI3Kδ抑制也具有明顯的免疫調節活性,主要是T細胞介導的,在B細胞惡性腫瘤的早期試驗中未得到充分重視,導致了阻礙臨床進展和套用的irAE。」
LJI和利物浦大學的研究人員在報告中使用了最近在英國進行的一項臨床試驗的樣本,該試驗涉及使用口服PI3Kδ抑制劑AMG319進行治療的頭頸癌患者。
PI3Kδ抑制劑是癌癥免疫治療領域的新產品,但它們有望抑制調節性T細胞(Treg)。Tregs通常會試圖阻止其他效應T細胞靶向人體自身的組織。抑制腫瘤內的Treg可以讓效應T細胞釋放並產生抗癌的CD8+T細胞。「擁有一種可以消除Treg的口服片劑——對於腫瘤學家來說可能是一筆巨大的財富。」Vijayanand說。
在該團隊進行試驗時,PI3Kδ抑制劑已被證明對B細胞淋巴瘤有效,但尚未在實體瘤中進行試驗。正如研究人員所承認的那樣,雖然證據確實表明,與其他T細胞亞群相比,PI3Kδi優先抑制Treg,「……到目前為止,還沒有在人類身上進行任何試驗來明確探索這一概念。」
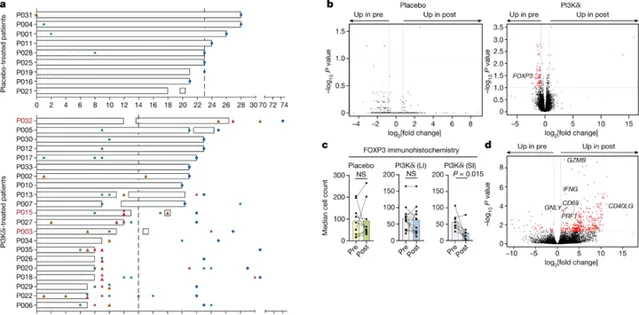
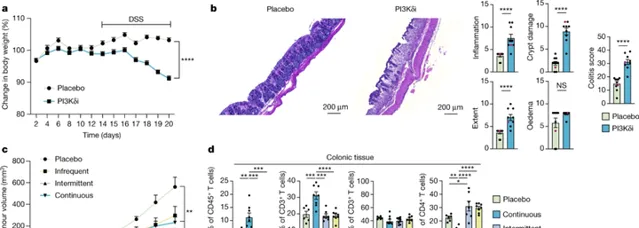
他們報告的新輔助、雙盲、安慰劑對照的隨機II期試驗評估了AMG319在人類頭頸癌患者中的療效。不幸的是,他們發現超過一半的服用該藥物的患者不得不提前停止治療,因為他們的結腸出現了炎癥,這種情況稱為結腸炎。「在AMG319的測試劑量下,21名接受AMG319治療的患者中有12名因免疫相關不良事件需要停止治療,這表明對Treg細胞有全身性影響。」研究小組指出,「因此,在小鼠模型中,PI3Kδi全身性地減少了Treg細胞的數量,並導致結腸炎。」
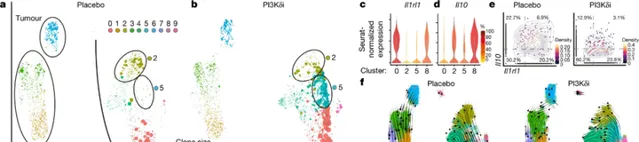
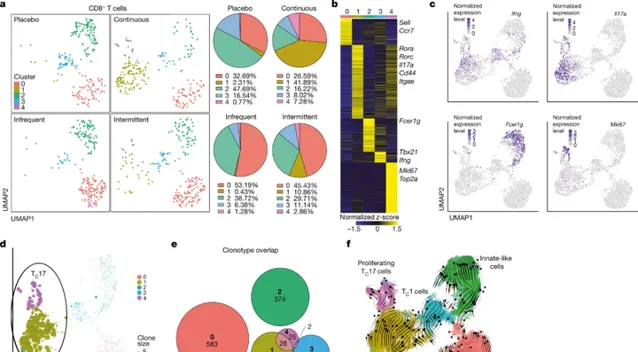
「我們認為這種藥物不會有毒,那麽為什麽會發生這種情況?」Vijayanand問道。LJI講師Simon Eschweiler博士隨後帶頭回溯並確切了解PI3Kδ抑制劑治療如何影響患者的免疫細胞。透過單細胞基因組測序,他發現在腫瘤中增加抗腫瘤T細胞的過程中,PI3Kδ抑制劑還阻止了特定的Treg細胞亞群對結腸的保護。在沒有Treg的情況下,致病性Tp7和Tc17細胞進入體內,導致炎癥和結腸炎。研究人員進一步解釋說:「單細胞RNA測序分析顯示,駐留在組織中的結腸ST2 Treg細胞因PI3Kδi而遺失,伴隨著致病性T輔助細胞17(Tp7)和17型CD8+T(TC17)細胞的擴增,這可能是導致毒性的原因;這指向了irAE出現的特定作用模式。」
很明顯,癌癥試驗患者接受的PI3Kδ抑制劑劑量超出了他們的需要,免疫療法使腸道中免疫細胞的微妙組成失去了平衡。該團隊還透過對小鼠模型的研究發現,間歇給藥可能是一種有效的治療策略,將持續的抗腫瘤免疫與降低毒性結合起來。他們現在正在設計一項人體臨床試驗,以在人體內測試間歇給藥策略。
「很明顯,在HNSCC患者的新輔助治療環境中,在評估劑量和日常安排下,PI3Kδ抑制具有不利的安全性,透過引起頻繁和嚴重的3/4級irAE,限制了其可行性和臨床益處,這可能是由調節非惡性組織中的Treg細胞行為引起的。」他們寫道,「在小鼠模型中間歇給藥PI3Kδi的改良治療方案導致腫瘤生長顯著減少,而不會在結腸組織中誘導致病性T細胞,這表明替代給藥方案可能會限制毒性……根據我們的研究結果,在實體瘤治療中,需要減少劑量或改變PI3Kδi治療方案——尤其是免疫力強的患者——以便能夠利用PI3Kδi誘導的明確的抗腫瘤免疫反應,同時限制與健康組織中Treg功能降低相關的副作用。」
Eschweiler認為,在他們報告的研究中發現的導致毒性的途徑也可能廣泛適用於含有類似Treg細胞的其他器官,以及其他靶向Treg細胞的免疫療法,例如抗CTLA-4。
但是如何解釋B細胞淋巴瘤試驗中缺乏毒性呢?Eschweiler認為,在之前的研究中,淋巴瘤患者曾接受過多種治療,導致整體免疫功能低下。這意味著淋巴瘤患者在PI3Kδ抑制後沒有相同類別或相同程度的免疫反應。相比之下,頭頸癌患者未接受過治療。他們的免疫系統沒有受損,因此與免疫相關的不良事件發生得更快、更明顯。
總的來說,這項新研究表明,不僅要研究個人化治療,還要研究個人化治療的劑量和時間表。正如Ottensmeier解釋的那樣,十年前醫生們只能提供一種免疫療法。它要麽對患者有幫助,要麽沒有。如今,醫生們有一個快速增長的免疫療法庫可供選擇。因此,根據他們報告的研究結果,該團隊表示,「……我們的數據表明,每位患者TME中效應細胞與調節細胞的獨特細胞組成可能是PI3Kδ抑制效果的重要決定因素。因此,PI3Kδi可能對腫瘤內Treg細胞水平高以及治療前樣本中Treg與CD8+腫瘤浸潤淋巴細胞(TIL)比例不利的患者特別有用。」
Vijayanand和Ottensmeier是首批使用單細胞基因組測序工具來確定哪種治療組合對個體患者最有效以及提供這些治療的最佳時間安排的研究人員。在2021年【Nature Immunology】的一項研究中,這兩位科學家展示了按特定順序進行免疫治療的潛在重要性。「如果你能很好地設計臨床試驗,並套用復雜的基因組學,你就有很多東西需要學習。」Vijayanand說,「你可以弄清楚發生了什麽,然後回到患者那裏。」









