熱塑性聚氨酯(TPU)的3D打印(3DP)技術在醫療行業正受到越來越多的關註,這得益於 TPU 所具有的可調特性,以及 3DP 工藝在制造精度、時間和成本方面所提供的可能性。我們研究了透過熔融沈積建模(FDM)實作醫用級TPU的套用,用於從原材料顆粒到Gamma射線(γ)滅菌的3DP構件制造可植入醫療器械。透過差示掃描量熱法(DSC)分析熱效能和體積排除色譜法(SEC)測量分子量,作為整個制造過程中的監測指標。γ輻照滅菌後,透過水接觸角(WCA)測量和紅外光譜(ATR-FTIR)評估表面化學性質。機械效能透過拉伸測試進行研究。化石相容性透過細胞毒性(ISO 10993-5)和血液相容性(ISO 10993-4)檢測進行評估。結果顯示,TPU在制造過程中發生降解,平均數分子量(Mn)和加權平均數分子量(Mw)均減小(7%的Mn損失,30%的Mw損失,p < 0.05)。γ輻照滅菌後,Mw增加了8%(p < 0.05),表明可能發生了交聯。然而,輻照對拉伸效能沒有影響。經滅菌後,細胞活力(132% ± 3%,p < 0.05)和紅細胞溶解度均未受到影響。結論是,Gamma射線滅菌對熱塑性聚氨酯的套用影響不大。研究證明了熱塑性聚氨酯透過 FDM 和Gamma射線滅菌後的可加工性,並可作為制造與血液接觸的植入式醫療器材的聚合物原材料初步評估指南。
一、簡介
3D打印(3DP)是指透過電腦輔助設計從虛擬模型構建真實的三維物體的過程。長期以來,3DP一直被用作汽車和航空航天等行業的快速原型制作技術,現在已擴充套件到其他領域,包括生物醫學和藥學領域。最初,3DP使用各種熱塑性聚合物來制造生物材料,例如聚乳酸(PLA)、聚己內酯(PCL)、聚乳酸-聚乙二醇酸(PLGA)或聚甲基丙烯酸甲酯(PMMA)。從組織工程到骨科手術、牙科、心血管和頜面外科等多個醫學專業都受到了影響。隨著近期技術的進步,更多具有獨特效能的聚合物正透過 3DP 工藝套用於細分領域。事實上,聚芳醚酮(PAEK)和熱塑性彈性體(TPE)等聚合物家族因其特殊的機械效能而引起越來越多的關註。此外,具有形狀記憶特性的特殊聚合物復合材料(雙層封裝的PCL-TPU)正在設計和套用於4D打印中,這引入了在外部刺激(光、溫度或pH環境)下變形3DP構件的概念。
熱塑性聚氨酯(TPU)是一種基於脂肪族聚醚段的高分子材料,這些聚醚段具有高流動性(稱為軟段,SS),並由剛性芳香族基團(稱為硬段,HS)分隔開來。事實上,在它們的熔點以下,TPU是由(或多或少半)結晶簇構成的兩相材料,其中HS透過π-π堆積相互作用聚集在一起形成硬域,散布在非晶相中,SS鏈相互纏結,形成軟域。這種特殊的組織結構為TPU提供了彈性特性。TPU的特性可根據其性質(SS 與 HS 的比例以及這兩相之間的分離程度)進行客製。從生物學的角度來看,TPU具有化石相容性和血液相容性,是一種極佳的候選材料。它被用作體外和植入式血液接觸醫療器械的原材料,如血袋、導管、血管移植物或動靜脈分流器。因此,透過 3DP 工藝實作TPU的套用是一個日益受到關註的話題。TPU具有廣泛的特性,結合快速制造、低成本和高分辨率技術,為醫療行業提供了一個有的趣組合。一些研究報道了使用熔融沈積成型(FDM)的TPU操作條件。這是一種廣為人知的3DP工藝,其基本原理是透過熔化聚合物的連續層疊來構建3D構件。
在制造植入式醫療器械的過程中,需要對基於聚合物的植入物進行滅菌處理。常用的滅菌方法有環氧乙烷或蒸汽氣體滅菌、Gamma射線或電子束輻照滅菌等,目的是消除活性微生物,避免感染。關於使用致電離輻射對TPU進行滅菌的影響已經在很多文獻中有詳盡的報道。數值研究發現,鏈斷裂(或鍵的斷裂)、交聯(或鍵的形成)以及支化是主要的現象。這些現象與材料的特性密切相關,通常會同時發生,導致聚合物的化學、熱學和力學效能發生變化。根據滅菌過程、接受的劑量強度和材料的性質,這些現象會相互競爭,結果導致TPU變脆、增韌、硬化、軟化和變色。醫療行業還要求對制造過程進行嚴格監控。以確保可靠性和可重復性。事實上,一旦發生效能變化,必須對其進行辨識和限制,以保證植入器材的安全性和質素。臨床表現顯然依賴於效能變化;因此,評估制造過程的影響及其程度非常重要。
本研究旨在評估熔融擠出3D打印技術和常用滅菌方法對TPU的影響,以此作為植入式醫療器材的制造途徑。在完成這項研究的同時,還對最終滅菌樣品的生物特性進行了初步評估。我們研究了 FDM 對醫用級TPU從原始顆粒到Gamma射線(γ)滅菌 3D 部件的影響。透過體積排阻色譜法(SEC)測量的分子量和差示掃描量熱法(DSC)評估的熱效能被用作該過程每個步驟的監測指標。透過水接觸角測量法(WCA)和紅外光譜法(ATR-FTIR)研究了滅菌後3D打印部件的表面特性,並透過拉伸測試研究其力學效能。此外,還分別根據 ISO10993-5 和 ISO10993-4 標準,透過細胞毒性和血液相容性檢測進行了生物學評估。
該研究提供了以下數據:(i) 關於經過 FDM 3D 打印後進行Gamma射線滅菌對醫用級TPU物理化學特性的影響;(ii) 評估經過 FDM 加工和滅菌的TPU結構的細胞毒性和血液相容性。
二、材料和方法
2.1. 材料
TPU醫用級材料由巴斯夫公司提供,原始顆粒形式交付。它是一種基於聚醚的TPU,其SS部份為聚四氫呋喃醚(PTMO),HS部份為4,4-二苯甲酰二異氰酸酯(4,4-MDI),擴鏈劑為1,4-丁二醇(1,4-BDO)。HPLC級(≥99.8%)的四氫呋喃(THF)由Honeywell Riedel-de HaënTM公司(德國S eelze)提供。用於制備磷酸鹽緩沖溶液 (PBS) 的碳酸鈉 (Na2CO3) 和鹽片由 Sigma Aldrich(Steinheim,德國)提供。HPLC 級乙醇(≥99.9%)由Fisher Chemical(比利 Geel)提供。
2.2. 樣品制備
2.2.1. 3D打印(FDM)
TPU部件的制造過程總結如圖1所示。為了進行FDM,原始的TPU顆粒被擠出(Composer 350,3devo,荷蘭)成為直徑為1.75毫米的絲材。確定最佳溫度曲線是為了獲得規整直徑的幹凈絲材。從進料到擠出噴嘴的擠出溫度分別為155°C、175°C、181°C和185°C。單個擠出螺桿的旋轉速度為2.8 RPM。管狀樣品(高度:25 毫米;直徑:20 毫米;壁厚:0.8 毫米)使用開源軟件(On Shape, Boston, MA, USA)進行設計,然後進行切片處理(Simplify3D, Cincinnati, OH, USA),最後使用 FDM(Stream 20 Dual MK2, Volumic, France)按照表 1 中的參數用上述長絲進行 3D 打印。
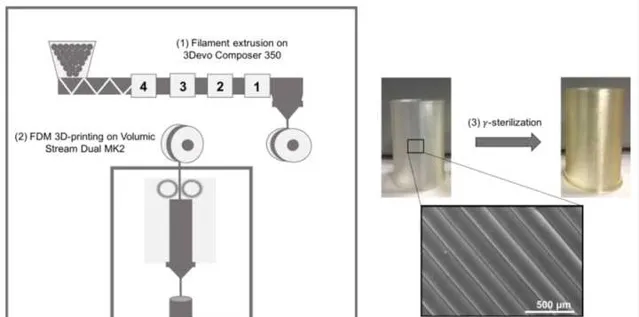
圖 1. FDM 加工TPU部件的生產路線。

表 1. FDM 加工TPU部件的處理參數。
2.2.2. 滅菌
根據 ISO 11137-2 標準,對 FDM 樣品進行 40 kGy 劑量的Gamma射線(γ)輻照,以對血管位置的植入式醫療器械進行滅菌。透過對鈷 60(60Co)放射源產生的致電離輻射進行照射,使用該工藝對醫療器械進行滅菌的最低劑量為 25 kGy。這一劑量可確保微生物的存活概率小於或等於 10^(-6)。
2.3. 樣品特征描述
2.3.1. 水接觸角測量 (WCA)
接觸角測量是使用配備光學系統的測角儀(Minitec DSA100,Krüss,德國)進行的,該系統可捕捉水滴並分析接觸角。使用註射器,采用 "Sawsen Sessile Drop "法將 2 μL 的蒸餾水滴在樣品表面。在樣品的不同區域進行測量,以考慮樣品的異質性。在室溫下對每個樣品進行了六次測量。基線(即 FDM 樣品表面)與三相點(固-液-氣)處液滴輪廓線的切線所形成的角度就是我們的接觸角。
2.3.2. 紅外光譜分析(ATR-FTIR)
根據衰減全反射(ATR)法,對 FDM 樣品進行了傅立葉變換紅外光譜(FTIR)分析。研究使用紅外光譜儀(SpectrumTwo,Perkin Elmer,法國)及其同名相關軟件(Spectrum 10.6.0 版)進行。該研究在室溫下進行,在波數範圍為 4000 cm^(-1) 至 450 cm^(-1) (分辨率為 2 cm^(-1) )的範圍內進行 16 次掃描後,以吸光度模式記錄了每個研究樣品的三條光譜。這些數值以 ASCII 格式從軟件中匯出,以便在 Excel 中追蹤吸光度光譜。
2.3.3. 差示掃描量熱法(DSC)
對樣品進行差示掃描量熱法(DSC Q100,TA Instruments,Guyancourt,法國)測定。在惰性氣氛(N2,0.8 巴)下,以 50 mL-min^(-1) 的流量將約 5 毫克樣品密封在標準鋁制膠囊中。一個空的標準鋁膠囊用作參照物。在-65℃至 +260℃的溫度範圍內,以 10℃-min^(-1)的斜率進行加熱-冷卻-加熱迴圈,記錄熱流隨溫度變化的熱分析圖。每個樣品繪制三張熱分析圖。玻璃化轉變溫度 Tg 被視為中點溫度,熔融溫度則取最大峰的熔融吸熱結束溫度。
2.3.4. 體積排阻色譜法(SEC)
使用配備 HR-1、HR-3 和 HR-4 色譜柱(500-500,000 g-mol^(-1))的 WATERS E2695 色譜儀(Waters,Waters Corporation,Milford,MA,USA)和差示折射儀(Optilab-T-rEX,Wyatt Technology,Santa Barbara,CA,USA)進行體積排阻色譜分析。該系統使用標準聚苯乙烯溶液進行校準。將15毫克的樣品溶解在3毫升的四氫呋喃(THF)中(n=6)。每升 THF 加入 1mL 甲苯。隨後,這些測試溶液透過孔徑為 0.45 μm 的聚四氟乙烯(PTFE)膜過濾,然後轉移到玻璃瓶中。使用 Astra 6 軟件(Astra 6,Wyatt Technology,USA)進行數據處理。
2.3.5. 拉伸測試 在平行和垂直於樣品打印層的方向上切割啞鈴試件(12 毫米 × 4 毫米)。使用的試驗台是萬能牽引機(Instron 4466,Norwood,MA,USA),配有 37℃ 的恒溫室。拉伸試驗的初始應變速率為 3.5 × 10^(-3)-s^(-1),直至樣品斷裂。測試按照 ASTM D638 塑膠拉伸效能標準進行,進行了三次重復測試。
2.4. 化石相容性評估
2.4.1. 細胞毒性
根據 ISO 10993-5 標準,我們采用提取法(間接接觸法)評估了生物材料與人肺微血管內皮細胞(HPMEC)的潛在細胞毒性。在 Innova40 振蕩培養箱(New Brunswick Scientific, Illkirch, France)中,將表面積為 1.6 平方厘米的 FDM 打印矩形樣品(無論是否經過 γ 消毒)浸泡在 1.066 毫升 HPMEC 細胞完全培養基(CCM)中,在每分鐘 80 轉、溫度為 37℃ 的條件下進行 72 小時的萃取。每組樣品均重復三次。在加入提取培養基的前一天,將含有 100 µL CCM 和每孔 4.0 × 103 HPMEC 細胞的 96 孔組織培養板置於 37℃、5% CO2 的環境中培養 24 小時。24 小時後,首先對提取培養基進行過濾除菌(0.22 µm Filtropur,Sarstedt,Nümbrecht,Germany)。然後,從單層細胞中取出培養基,每孔加入 100 µL 過濾提取培養基或 CCM(陰性對照,即無細胞毒性)。
細胞暴露於提取培養基 24 小時後,采用 AlamarBlue® 測試法評估細胞活力。Alamarblue 溶液最初為藍色並被氧化,當被真核細胞中與呼吸活動有關的酶還原後,會變成紅色並行出熒光。簡而言之,從細胞中移除提取液,每孔加入 200 µL 10%的 AlamarBlue(ThermoFisher Scientific,Illkirch,France)CCM 溶液,在 37℃ 避光條件下培養 2 小時。然後,將每個孔中 150 µL 的 AlamarBlue 溶液轉移到黑色透明底 96 孔板中,用微孔熒光儀(TwinkleTMLB 970,Berthold Technologies GmbH & Co,Wildbad,德國)在 530 nm 的激發波長和 590 nm 的發射波長下測量熒光。然後將結果與陰性對照(CCM)的結果進行歸一化,以表示測試組的相對細胞活力。
2.4.2. 血液相容性分析
在下面的測試中,使用19號蝶形針從一名健康成年誌願者(年齡26歲)的靜脈采集新鮮的人類全血,並用1.5 IU肝素/毫升(Leo Pharmaceutical Products BV, 荷蘭Weesp)進行抗凝。
2.4.3. 溶血
當與生物材料接觸時,化學物質或可溶性物質與紅細胞的相互作用可能導致它們的破裂(溶解)和細胞內血紅蛋白的釋放,血紅蛋白是紅細胞的主要成分,也是其紅色的原因。因此,進行了體外溶血測試,以評估材料對紅細胞的潛在影響。將表面積為2.4平方厘米的FDM打印的矩形樣品(無論是否經過 γ 消毒)與 1 毫升 PBS 一起在 37℃、80 轉/分鐘的攪拌條件下預處理 30 分鐘。每組樣品都有三個復制品。不含樣品的 PBS 作為陰性對照,即不溶血;不含樣品的 0.1% Na2CO3 作為陽性對照,即完全溶血。調節後,將樣品膜浸泡在每個樣品中的1毫升人全血中,然後在 37℃、80 rpm 的攪拌下培養 1 小時。然後,從每個孔中收集血液並轉移到相應的玻璃試管中,以 500×g 離心 5 分鐘。使用紫外分光光度計(UV-1800,Shimadzu,Marne La Vallee,France)在541納米波長處測量離心管中收集的上清液的吸光度(即遊離血紅蛋白的吸光度峰值)。按照以下公式計算溶血率:

2.4.4. 血細胞附著 在上述測試中與人全血接觸後,FDM打印的樣品被轉移到一個新的12孔組織培養板中。為了進行掃描電鏡觀察的預處理,將每個樣品浸泡在每孔 1 mL 的 2.5% 戊二醛溶液中,在 4℃ 下固定 30 分鐘。然後使用不同濃度的乙醇溶液對樣品進行逐漸脫水:50%、60%、70%、80%、90%和100%。表面預先鍍有鉑塗層(5 nm 厚),在FlexSEM1000掃描電子顯微鏡(日立,法國)下以5千伏的電子加速電壓、10微安的發射電流和300倍放大倍數進行觀察。
2.5. 統計分析
結果以均值±標準差的形式呈現。統計分析使用Excel進行。對比兩組數據時,采用雙向Student t-test。對比多個組別與對照組時,進行單因素變方分析(ANOVA one-way)。當p ≤ 0.05時,兩組或多組之間的差異被認為是顯著的。
三、結果
3.1. FDM制造工藝和材料消毒對TPU的影響
使用SEC(圖2)中的分子量(Mw、Mn)和多分散指數(Ip)來研究TPU的制造工藝以及隨後的消毒對其的影響。首先,Mw從155,000 ± 14,000克/摩爾降至108,000 ± 900克/摩爾(累計下降30%,p < 0.05),而Mn從68,000 ± 6000克/摩爾降至58,000 ± 3800克/摩爾(累計下降15%,p < 0.05)從顆粒狀到3D打印形式。這種分子量的下降可以歸因於原始TPU顆粒擠出成絲以及3D打印過程中的降解。經過γ-輻射消毒後,Mn保持在59,000 ± 3400克/摩爾,而Mw增加至117,000 ± 2800克/摩爾(增加8%,p = 0.0002)。這種增長可能是大分子鏈之間交聯的結果。盡管如此,TPU在消毒後仍能在THF中溶解。
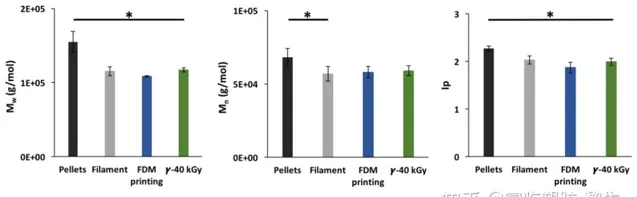
圖2. 制造過程對Mw(a)、Mn(b)和Ip(c)的影響。數據以均值±標準差表示(n = 6),* p < 0.05(在每個處理步驟之間,Student t-test)。
圖 3 顯示了TPU顆粒、絲狀、3D打印和γ輻射消毒樣品的首次加熱和隨後的冷卻迴圈的DSC圖譜。第一個拐點在 -50℃到 -40℃之間,與TPU軟域的玻璃化轉變溫度 (Tg) 有關。65°C左右的第二個拐點與硬段的松弛相對應。表 2 列出了從 DSC 收集到的數據。在擠出步驟後,Tg1從-50 ± 2℃略微增加至-45 ± 1°C。Tg2在原始顆粒中並不明顯,在擠出後可在64 ± 3℃檢測到,然後在FDM處理後降至52 ± 2℃(p = 0.03)。此外,Tm從164 ± 1℃保持恒定至163 ± 1℃(p = 0.04),而ΔHm略微減小,從13.8 ± 0.5 J/g降至11.2 ± 0.5 J/g(p = 0.0004)。消毒後,Tg1值保持不變,而Tg2明顯上升至61 ± 3℃。Tm略微從163 ± 3℃增至165 ± 1℃,而ΔHm值的變化不顯著(p = 0.68)。
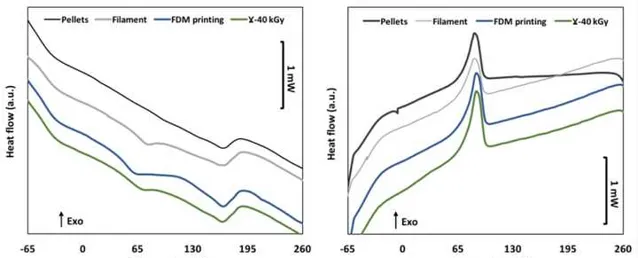
圖3. 原始顆粒、擠出絲狀、FDM加工和滅菌樣品的首次加熱過程(a)和冷卻過程(b)的DSC曲線。

表2. 從首次迴圈中收集到的DSC數據(n = 3)(均值±標準差)。
透過拉伸測試研究了滅菌對 FDM 樣品機械效能的影響(圖 4)。表 3 總結了拉伸曲線的收集數據。三維打印樣品表現出彈性行為,楊氏模量為 14.1 ± 1.2 兆帕,斷裂伸長率為 697 ± 17%,在擠出絲平行方向拉伸時為 697 ± 17%,在擠出絲垂直方向拉伸時降至 378 ± 15%。事實上,層間粘附界面是引發和傳播失效的薄弱點。經過γ射線滅菌後,TPU的拉伸效能並沒有發生顯著變化,楊氏模量、斷裂應力和斷裂應變分別在與打印層平行的方向上略微增加了4%、11%和4%,而在與打印層垂直的方向上分別增加了1%、8%和17%。統計分析顯示這些差異不具有顯著性(p > 0.05)。

圖 4:(a)FDM 加工和滅菌處理後的TPU樣品的拉伸曲線;(b)沿垂直和平行於打印層方向切割的啞鈴(紅線代表斷裂位置)。

表 3. 拉伸曲線數據(n = 3):楊氏模量 (E)、斷裂應力 (σb) 和斷裂應變 (εb)(平均值 ± SD)。
3.2. 滅菌後3D打印樣品的表面效能
在滅菌後,原本透明的3D打印樣品變成了黃色。水接觸角(WCA)測量顯示,TPU樣品的表面疏水性略有下降,WCA 從97.2 ± 1.80°下降到94.56 ± 2.80°。在電子束滅菌後TPU的性質發生了變化。樣品的表面化學性質透過ATR-FTIR進行了分析。如圖5a所示的光譜是相對於1077 cm^(−1)波段進行了歸一化處理的。在對照樣品和滅菌樣品之間觀察到了一些差異。在圖5b、c中,可以觀察到3326 cm^(−1)(N-H伸縮振動)、2940 cm^(−1)和2850 cm^(−1)(C-H伸縮振動)波段的變化。對於γ-滅菌樣品:3326 cm^(−1)波段在3300 cm^(−1)處出現了一個輕微的肩峰,2940 cm^(−1)波段開始分裂,最後對於2852 cm^(−1)波段,峰值略微向2850 cm^(−1)處移動。3326 cm^(−1)、2940 cm^(−1)和2850 cm^(−1)處的變化是乙烯雙醯胺(EBS)的特征,EBS作為歐洲藥典認可的潤滑劑,,透過小規模鏈裂解遷移到TPU樣品表面。
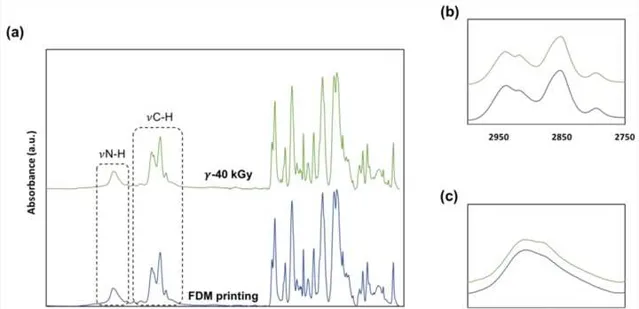
圖5. (a) FDM加工和滅菌樣品的4000 cm^(-1)到400 cm^(-1)範圍內的ATR-FTIR光譜。(b) 2940 cm^(-1)處的分裂和從2852 cm^(-1)到2850 cm^(-1)的移動;以及(c) 在3300 cm^(-1)處出現的肩峰。
3.3. 滅菌後3D打印樣品的生物學效能
3.3.1. 細胞毒性
細胞存活率如圖6a所示。與控制組(100%細胞存活率)相比,未經滅菌的樣品和γ-滅菌樣品的聚合物萃取物分別顯示出151% ± 2%和132% ± 3%的細胞存活率。因此,由於相對細胞存活率遠遠超過ISO10993-5標準中定義的非細胞毒性閾值70%,滅菌處理似乎並沒有對FDM加工材料的非細胞毒性產生負面影響。滅菌材料的細胞存活率比未經滅菌的樣品低 12%,但無統計學意義(p > 0.05)。

圖6. γ射線滅菌對FDM加工的TPU結構生物學效能的影響:細胞存活率(a);溶血率(b);以及FDM加工後(經過和未經γ滅菌)血液接觸後的掃描電鏡照片(c)* p < 0.05(與對照組比較,單向變方分析)。
3.3.2. 血液相容性
溶血性根據方程式(ϕ)計算的溶血率數值(圖6b)顯示,如預期的那樣,陽性對照組(即0.1% Na2CO3)產生了100%的溶血,而陰性對照組(即PBS)沒有產生任何溶血。就測試材料而言,經過或未經γ滅菌處理的兩組均未表現出溶血活性(0%)。
血細胞粘附暴露於人體全血 1 小時後,在掃描電子顯微鏡下觀察 FDM 制成的樣品(經過或未經過 γ 消毒)的表面(圖 6c)。雖然兩組樣品表面都粘附了紅細胞,但材料表面粘附最多的血細胞是血小板。關於附著血小板的形態,在經過 γ 消毒的樣品上,血小板沒有顯示出明顯的偽足;而在未經消毒的 FDM 樣品上,則發現了扁平而平展的血小板,並有大量延伸的偽足。這種形態轉變被認為是血小板活化的標誌,首先是圓形血小板的粘附,然後是血小板或樹枝狀血小板的適度形態變化,並帶有偽足,接著是血小板的扁平化和擴散。因此,與經過滅菌處理的樣品相比,未經滅菌處理的FDM樣品表面上附著的血小板的活化程度更高。這意味著γ滅菌處理減少了血小板在TPU表面上的活化。
四、討論
研究旨在評估使用3DP技術生產醫療器械時對TPU降解的程度。生產路線包括透過FDM將 TPU 從原始顆粒加工到 3D 打印,然後透過40 kGy劑量的γ輻射對3D結構進行滅菌處理。
FDM被選擇是因為其具備醫用級原材料的可用性,易於使用並能適應規模化生產。在醫療行業中,要求對醫療器械的制造過程進行精確監控,以實作每個制造的物品都具有相同的質素和效能。透過對連續打印的3D結構的分子量進行重復性研究,證明了FDM是一種可重復的技術。在多次連續打印後,Mn和Mw保持不變,驗證了經過詳細最佳化參數(如擠出流量、打印速度、擠出噴嘴和床溫度)後的打印參數的有效性(附加數據)。在制造過程中,TPU經歷了兩個連續的高剪下應力的加工步驟,即擠出和3D打印,以獲得管狀的3D結構。研究表明,隨著分子量的降低,聚合物在這兩個步驟中都發生了降解,直至最終累積損失三分之一的 Mw。熱分析顯示玻璃轉變溫度的變化,即Tg1的增加和Tg2的降低。這種模式意味著連續的加工步驟可能會引入更多的相混合和TPU軟硬域之間的重新排列。軟域中小規模或非理想排列的 HS 的溶解可以解釋 Tg1 的升高。當此溫度接近聚醚鏈的Tg時,TPU中軟硬域之間的相分離程度增加。PTHF 均聚物的 Tg 為 -79 ℃。同樣,對於 Tg2,未加工顆粒中的 HS 域不包含無定形段,因此無法顯示玻璃化轉變溫度。在擠出步驟中,結晶和無定形相的重組導致了HS和SS之間更多的相混合,從而導致可檢測到的Tg2。這種現象是透過在硬軟域之間的界面發生小規模鏈斷裂來實作的。
植入醫療器械必須無菌。選擇Gamma射線滅菌是因為它是一種常見、高效的方法,在文獻中也有大量記載。根據歐洲藥典所要求的無菌保證水平,需要使用25 kGy劑量進行滅菌。3D打印的樣品經過40 kGy的劑量進行了滅菌。滅菌會導致FDM樣品出現了肉眼可見的顏色變化。輻照樣品發黃是由於TPU氧化以及疏水性降低的結果。關於TPU在不同能量輸入下的氧化機制已經提出了幾種假設,包括將雙苯甲基組轉化為含共軛雙鍵的聯烯基。輻射過程中氧氣與自由基反應產生的自由基可以啟動這些機制,而這些色團結構的形成導致共軛雙鍵的積累,從而引起顏色變化。透過紅外光譜進行的表面特性研究表明,在滅菌後表面化學性質發生了變化。在制造植入式醫療器材時,必須預計到添加劑會從TPU表面釋放到生物介質中,因此必須進行毒性研究。此外,已證明,交聯是透過自由基重組的方式發生的。經過輻照的 FDM 加工熱塑性聚氨酯的拉伸效能保持不變。人們可能會認為,隨著交聯的發生,TPU會變硬並失去彈性性。假設在低於200 kGy劑量時,交聯對TPU的影響是不可辨識的。商業TPU對輻射具有一定的抵抗力,直到達到數百kGy的閾值。透過「僅僅」接受40 kGy的劑量,TPU的彈性效能保持完好,並符合我們的套用要求。
除了物理和分子行為外,經過 FDM 加工和 γ 滅菌處理的TPU的生物特性也必須符合醫療器材的設計用途。滅菌前後的 FDM 樣品均未顯示出溶血活性,因此適合用於與血液接觸的植入物。此外,不僅FDM加工的TPU表現出非細胞毒性行為,而且在輻照後細胞存活率仍然極高,超過70%。眾所周知,商業TPU在配方中加入了潤滑劑和抗氧化劑等添加劑,以獲得理想的效能。我們之前提出了這樣一個可能性,即經過滅菌後,EBS潤滑劑透過同時發生的小規模鏈斷裂和交聯作用遷移到了我們FDM加工的TPU樣品的表面。研究了這種潤滑劑對環狀烯烴共聚物生物特性的影響。發現:(i) 透過對 HUVEC 細胞進行 MTT 檢測,細胞存活率從 175% 降至 150%;(ii) 粘附性和血小板活化程度降低。血小板的粘附和活化是血栓形成的基本步驟。
考慮到經γ輻射滅菌後,3D打印的TPU結構表面血小板粘附減少和較少的進一步活化,TPU的生物學效能在Gamma輻射滅菌後有所改善。為了進一步篩選,必須對 FDM 加工和γ滅菌TPU的體外生物耐久性進行評估,因為加工過程中觀察到的分子量降低可能導致機械效能的早期喪失,此外,還應評估拓撲結構和表面孔隙率隨時間的變化,以評估對細胞粘附和增值的影響。
五、結論
對於3D打印和Gamma射線滅菌血液接觸植入物的設計,熱塑性聚氨酯似乎是一個可行的候選材料,盡管在連續的加工步驟(即擠出和3D打印)中,FDM 加工對其分子完整性產生了破壞性影響。使用Gamma射線進行滅菌似乎會誘發交聯。盡管如此,熱塑性聚氨酯的機械效能並未受到影響,生物效能也符合套用要求。經Gamma射線滅菌後的樣品沒有細胞毒性,也不會誘發血小板活化,因為Gamma射線滅菌後的樣品血小板活化程度較低。根據FTIR分析,我們懷疑在TPU配方中使用的一種眾所周知的潤滑劑,即EBS,在材料表面遷移。其在材料表面的存在情況將在後續的研究中進行調查。最終,要想從風險評估的角度批準這種制造方法,後續研究還應該包括對熱塑性聚氨酯的體外生物耐久性進行評估,並對可浸出化合物進行分析。
富臨塑膠供應長期植入級3D打印聚氨酯材料:聚碳酸酯聚氨酯、有機矽聚氨酯共聚物
公司地址:廣東省東莞市樟木頭鎮塑金國際1號樓810












