3月18日,Science上發表了題為「腫瘤早期檢測(Early detection of cancer)」的文章,下面我對這篇文章進行全面的解讀。

為啥現在寫?為啥這幾個人寫?
Nature、Science就某個特定的領域發表綜述並不多,往往會過3~5年或5~10年才會有一篇重磅的綜述。這種綜述通常是約稿,那麽 為何現在會發表這個腫瘤早期檢測這個主題的綜述呢?
作者認為,現在是腫瘤早期檢測的風口。當前,我們對腫瘤的認知越來越充分,技術的進步也為我們提供了更有力的工具去揭示腫瘤發生的機制,政府或者私人的基金對腫瘤早期檢測越來越關註。原文是「We believe that early detection of cancer is approaching a tipping point , as biological insight and technological capacity are increasing at an unprecedented rate and as public and private funders of research are increasingly willing to invest」。Tipping point,即臨界點、引爆點。站在風口上,豬都會飛。腫瘤是個長期存在的話題,新冠疫情可能會結束,但腫瘤將會長久伴隨著我們。
既然要寫這篇綜述, 為什麽由這些人來寫,為啥Science不邀請我來寫? 哈哈!或者換個說法,這幾個人在腫瘤早期檢測領域,做出過啥貢獻。首先,我們看一下這篇文章的第一作者和通訊作者,來自英國癌癥研究中心的David Crosby 。 查了一下,Crosby是英國癌癥研究中心下屬的腫瘤預防和早期檢測研究中心的主任(Head of Prevention and Early Detection Research)。

我查一個人的學術貢獻,通常會直接去Google Scholars查詢作者的H-index,雖然我找到了David Crosby,但我發現只有1999~2005年之間的13篇文章,顯然哪裏除了問題,可能是David Crosby自己後來關閉了Google Scholars?我繼續挖了一下,發現David Crosby近幾年發了幾篇腫瘤早期檢測的文章。


比如2020年11月在Lancet Oncology上發表的A roadmap for the early detection and diagnosis of cancer;還有2022年1月在British Journal of Cancer上發表的關於腫瘤液體活檢的評論性文章。先約上,以後有機會再講。
至於文章最後的通訊作者 Shankar Balasubramanian ,這人眼熟呀!
這是劍橋大學的教授,他的研究聚焦於G-四聯體(G-quadruplexes),H-index高達100。G-四聯體是特殊的DNA結構,我們以後也可以講一下G-四聯體的專題。不過我有點困惑的是,為啥Shankar Balasubramanian會出現在這篇腫瘤早期檢測的文章中。
早篩、早診、早期檢測,傻傻分不清楚
回到文章本身,文章題目中「Early detection」需要特別強調一下,這裏應該轉譯為檢測。我在很多文章中,往往看到作者將早期檢測、早期篩查、早期診斷混為一談,這裏需要明確區分開。用WHO在Guide to Cancer Early Diagnosis報告中的圖片解釋一下。
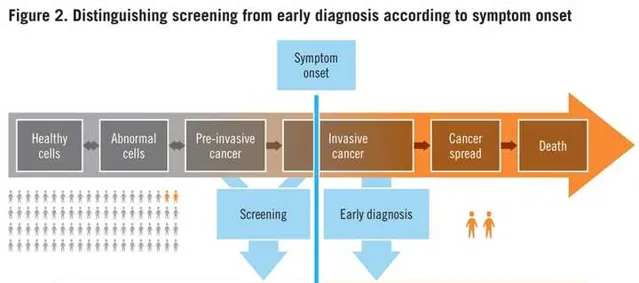
這裏可以看到,篩查(Screening)是指標對無癥狀的人群,之前沒有任何癥狀,比如你去做年度的體檢;而診斷(diagnosis)是指,有了癥狀以後,然後去醫院做各種全面的檢查,最終確診。而早期檢測(early detection)其實包括了篩查和診斷,甚至也包括了術後或治療後,對腫瘤復發的檢測,可以早期檢測到更小的復發訊號。
正文中,其實也明確提到了這一點:篩查是針對無癥狀的人群,而這篇文章聚焦到原發癌的早期檢測以及癌前病變,包括篩查和有癥狀人群的檢測。原文是:Screening, which proactively tests asymptomatic people, constitutes a subset of early detection measures. This Review focuses on early detection of primary cancers and precancerous changes in the context of both screening and symptomatic detection.
數據說話,腫瘤早期檢測的重要性
大約有50%的腫瘤一檢測到就是晚期(~50% of cancers are still only detected at an advanced stage)。早期檢測到底有多重要?一個直接的數據就是,在早期檢測到腫瘤的話,病人的存活率更高。
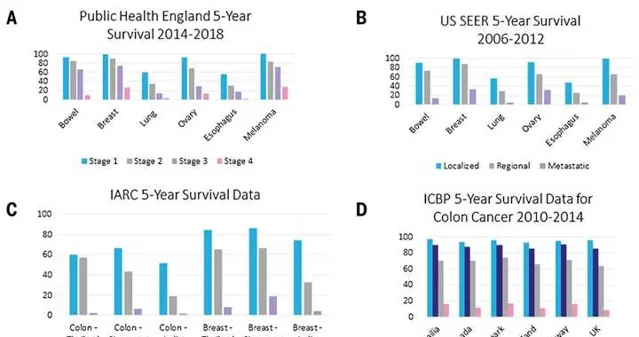
這裏給了四組典型的數據,A圖中是來自英國的數據,可以看到,對於直腸癌、乳癌、肺癌、卵巢癌、食道癌和黑色素瘤,在早期檢測到,比如第1期(Stage 1),黑色素瘤的五年生存率接近100%,而如果在第4期(Stage 4),五年生存率降到30%左右;其他癌癥的趨勢類似。B圖是美國的數據,跟英國的數據一致。C圖是WHO下屬的國際癌癥研究機構(International Agency for Research on Cancer,IARC)在東南亞的數據,可以看到在泰國南邦、新加坡和印度孟買,結腸癌和乳癌如果在早期被檢測到,比如還是局部的癌癥(Localized),患者的存活率更高;如果進展到區域的癌癥(Regional)或者進一步地,癌癥發生了擴散(Metastatic),那麽存活率會逐步降低。D圖是國際癌癥基準夥伴關系(International Cancer Benchmarking Partnership,ICBP)提供的關於澳洲、北美和歐洲已開發國家結腸癌的數據,也得到了類似的結論。總之,癌癥越早檢測越好!
想要吐槽的是,歐美這些國家癌癥數據統計方面確實比較領先一些,每年1月初,美國癌癥研究會會在影響因子高達500的神刊CA Cancer J Clin上發表過去一年美國的癌癥數據Cancer statistics;而中國的癌癥數據,則要滯後5~6年,比如今年2月27日,國家癌癥中心的赫捷院士等,在國產期刊Journal of the National Cancer Center (JNCC)上發表了中國的癌癥數據。

為啥有的癌癥可以在早期檢測到,而有的不行?
有一些癌癥,可以在早期檢測到,比如宮頸癌、乳癌、結直腸癌和肺癌等,而有一些癌癥,一旦檢測到大部份就是晚期,比如食道癌、胰臟癌和卵巢癌。一方面,是因為在宮頸癌、乳癌、結直腸癌和肺癌中,已經建立了相對完善的篩查流程,比如乳房X光攝影用來篩查乳癌,宮頸刮片用來篩查宮頸癌,糞便用來篩查結直腸癌以及低劑量螺旋CT篩查肺癌;而且我們註意到,X光和CT都是基於影像學的無創方式,而宮頸刮片和糞便也是無創的樣本。而對於食道癌、胰臟癌和卵巢癌,因為在身體內部,比較隱蔽,早期病變不容易覺察,也沒有太好的技術去做篩查。
值得註意的是,由於宮頸癌和乳癌篩查相對成熟,因此已經被納入到國家的「兩癌」篩查計畫。而乳癌和肺癌是全球發病率排名前兩名的癌癥,進行早期篩查可以有效提高患者的生存率。
早期篩查還與地區經濟水平密切相關。大約70%的腫瘤死亡病例來源中低收入國家。比如,1970~2011年撒哈拉以南的非洲黑人女性中超過60%的乳癌發現時就是晚期,而在美國同一時期的黑人女性中,晚期乳癌的比例從60%降低至32%。而對於宮頸癌,在欠發達地區有更高的死亡率。這裏作者使用了低人類發展指數的國家(low human development index (HDI) countries)。為什麽呢?一方面,在欠發達地區,大家的健康意識相對薄弱,篩查率相對較低;而且即使篩查出來了有問題,後期由於經濟方面的考慮,積極治療的意願相對較低。這也是國家大力推行「兩癌」篩查的原因吧。
腫瘤早期檢測的五大挑戰
挑戰1:認識早期腫瘤的生物學特性
這篇文章的格局比較大,首先提到了對於腫瘤的認知。我記得本科的時候【化學生物學】的老師講到:understand nature, then manipulate nature;即首先要認識自然,才能改造自然。但現狀是we do not fully understand which lesions will progress to consequential disease and which will not.
人們對於腫瘤的認識不斷加深。現在比較公認的是,腫瘤是由正常細胞轉化而來,而且腫瘤的發生發展是個連續的過程。首先,正常細胞發生了分子或者細胞水平的變異,這個時候可能細胞本身或者組織本身,並不能看到變化,好像是自己人中出現了叛徒,但難以辨認。隨後,這個細胞或者一團細胞具有生長或增殖的優勢,長得更快了,實作了從良性到惡性的轉變;進一步地,癌細胞的生長空間不夠了,就要去搶占地盤了,開始發生侵襲;空間還不夠,就會發生轉移。
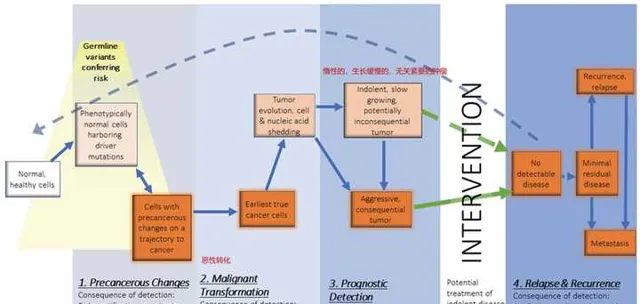
這個圖中是腫瘤發生經歷的歷程,在這些階段中,每個階段的腫瘤檢測都具有重要意義。比如癌前病變階段,註意這裏是癌前,因此還不能被稱為癌,只是一種病。有一些癌前病變很容易發展為癌,而有一些癌癥最終不會。比如結腸息肉發展為結腸癌的風險較高,一旦發現了,就需要進行及早幹預;而MGUS(未確定意義的單複制丙種球蛋白病),是血液中一種稱為M蛋白的異常免疫球蛋白水平中度升高的疾病,每年只有1%的可能性發展為多發性骨髓瘤;巴雷特食管(Barrett's esophagus)每年發展為食道癌的可能性只有0.3%。
一旦檢測到癌前病變,我們是否要立即進行幹預呢?不幹預自己又不放心;幹預了,但是風險確實較低,比如巴雷特食管(Barrett's esophagus),1000個人如果都進行了幹預,比如射頻消融,但最終只有3個人是真正有效的幹預,而剩下的997個人都是過度治療,造成醫療資源的浪費。因此, 關鍵的問題在於,如何判斷癌前病變的良惡性 。
癌癥如何才能實作更早期的檢測和判斷良惡性呢?由於早期分子層面的變化,現有的臨床手段很難檢測到,因此需要分子或細胞水平的檢測,比如對於MUGS患者,如果正要發展為陰燃性骨髓瘤(smoldering myeloma),甚至進一步發展為多發性骨髓瘤,這些MUGS患者的血液中檢測到了染色質變異和基因突變。這進一步說明了分子檢測的有效性。This demonstrates how detection and molecular stratification of a preneoplastic lesion can trigger intervention before clinically observed definite malignancy. 因此,分子檢測是現有臨床檢驗手段的重要補充。
當然,腫瘤不是孤立存在的,腫瘤有微環境,而且腫瘤細胞還會跟免疫系統存在互動。當細胞發生癌變以後,免疫系統也會出現變化,因此也可以使用基於免疫系統的標誌物檢測腫瘤。
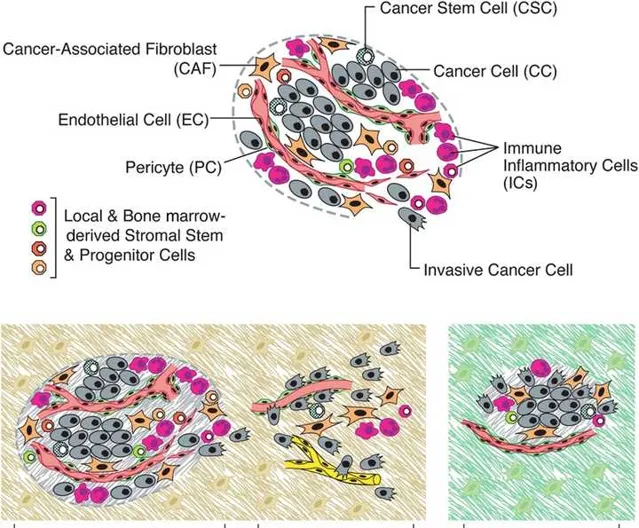
當然,為了更加系統和深入的研究腫瘤,腫瘤的生物學模型至關重要。第一代的模型是基因改造模型,比如透過基因剔除等途徑構建基因改造的腫瘤模型,可以揭示一些腫瘤細胞內在和外在的特性,但這些基因改造的模型不能最真實的反映人類腫瘤的情況。第二代模型是具有免疫活性的小鼠模型,進一步的模型還包括迴圈腫瘤細胞衍生外植體、腫瘤患者來源的移植瘤模型以及復雜的類器官模型。
挑戰2:鑒定風險人群
人生而平等,但每個人得腫瘤的風險/機率不同,因此每個群體使用的檢測策略也存在差異。Early detection strategies will not be of equal value to everyone. 我們比較容易理解的是,吸煙的人患肺癌的風險相對更高,那麽就更需要去做肺癌的篩查。如何評估哪些人更易患哪種癌癥,這就需要借助風險分級(Risk stratification)。
總的來說,一個人患癌的風險跟年齡、家族史、環境暴露以及生活方式相關。大家比較熟知的有好萊塢明星安吉麗娜·朱莉因為從母親那遺傳了 BRCA1 基因突變,患乳癌的機率高達87%,因此提前切掉乳房預防乳癌的故事。確實,攜帶遺傳性BRAC1和BRAC2突變的女性,患乳癌和卵巢癌的風險大大提高。
構建一個有效的風險分級模型需要大規模人群的臨床樣本和數據。目前英國Our Future Health initiative計畫招募了500萬名誌願者,美國的Project Baseline計畫招募了1萬名誌願者;亞洲的Asia Cohort Consortium招募了100萬名誌願者,而歐洲的 EPIC(European Prospective Investigation into Cancer and Nutrition)計畫招募了50萬名誌願者。這些大規模的縱向研究可以揭示腫瘤的風險因素,並有效評估不同人群對不同種腫瘤的易感性。

鑒定出風險人群後,這些風險人群要真正重視並列動起來,要積極開展早篩計畫。就像我們需要經常說服父母去做體檢一樣。即使在美國,2019年也只有不到5%的肺癌風險人群進行了肺癌的篩查,主要是由於醫療體系中篩查計畫的不健全以及個人本身的依從性不高。進行篩查後,還要進行科學合理的隨訪,才能真正起效。
道理大家都懂,為何最後卻依然做不好呢?可能沒有引起真正的重視吧。
挑戰3:發現並驗證標誌物
如果我們克服了前面兩個挑戰,比如知道了腫瘤在發生的早期,會有哪些分子層面的變化;我們也知道了,哪些人群是高風險人群,需要進行篩查計畫。但,在實際的操作層面,具體要檢測哪些指標呢?巧婦難為無米之炊,我們需要有標誌物才能進行腫瘤的早期檢測。
如何評價一個標誌物的好壞呢? 這裏有幾個指標,主要包括敏感性、特異性、陽性預測值和陰性預測值(positive predictive value,PPV)
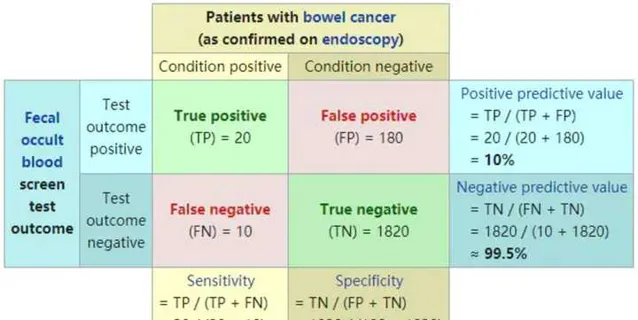
用上圖解釋一下這些概念。一共有2030個人接收了內鏡檢測,其中有30個人診斷為腸癌,而另外2000人沒有患腸癌。而一種新的腸癌標誌物,最終在30個腸癌患者中,檢測出20個,另外10個漏檢了,敏感性為20/30=67%;2000個未患癌的人中,檢測出了1820人未患癌,還有180人誤診為癌癥,特異性為1820/2000=91%。
從另一個角度想,這個標誌物一共檢測出了200個陽性,其中20個是真陽性,還有180個是假陽性,那麽陽性預測值PPV等於20/200=10%;這個標誌物一共檢測出1830個陰性,其中1820個是真陰性,還有10個漏檢的,那麽陰性預測值NPV為1820/1830=99.5%。由此可見,這個標誌物漏檢比較多,而且檢測的陽性中,真正陽性的只有10%,容易造成過度醫療,因此這個標誌物檢測腸癌並不理想。
透過這個舉例,我們可以看到,敏感性、特異性、PPV、NPV可以評估一個標誌物的有效性。
發現了一個標誌物,其實還需要進行 大量的驗證 。這裏作者舉了兩個失敗例子,前列腺特異抗原PSA用於前列腺癌以及CA-125用於卵巢癌的檢測。PSA is not generally recommended as a primary, population-level screen. Another example of a blood marker for cancer that showed promise was CA-125 for ovarian cancer. 這兩個標誌物有點雞肋,食之無味,棄之可惜。目前它們難堪大用,反而容易造成過度醫療。
此外,目前還湧現了不少新的標誌物,尤其是表觀遺傳的標誌物,比如DNA甲基化。標誌物主要從以下幾個維度理解,檢測的樣本型別是什麽?檢測的物質是什麽?檢測的指標是什麽?
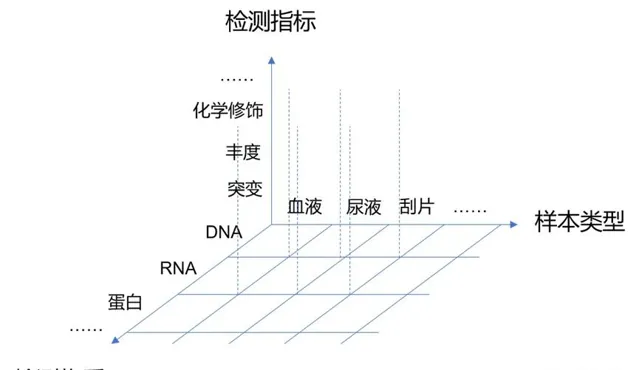
樣本型別包括血液、尿液、宮頸刮片等;檢測的物質包括DNA、RNA、蛋白或者代謝物等;具體檢測的指標包括突變、豐度和化學修飾等。比如我們要檢測血漿中ctDNA的豐度(即多少)、或者ctDNA的甲基化。
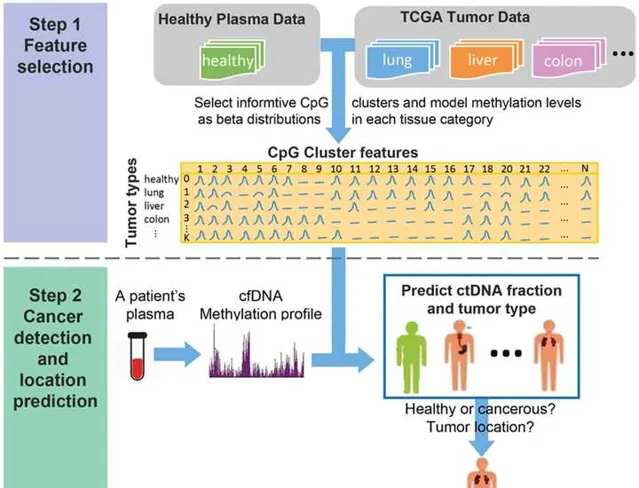
對於ctDNA的豐度的檢測,往往需要借助高通量測序,產生大數據,並利用人工智慧或者機器學習的演算法,來找到腫瘤患者中特有的特征。更進一步地,甚至還能追溯到患癌的器官。讓我印象深刻的是UCLA的Xianghong Jasmine Zhou教授在Genome Biology上發表的CancerLocator文章,透過分析正常人和腫瘤患者血漿中cfDNA的差異,並利用這種差異鑒定檢測者患癌的風險以及癌癥種類。
盡管人工智慧或者機器學習模型已經有越來越多的套用,但作者也提到了它的弊端,即演算法本身是怎麽找出這些特征或者標誌物的,是不知道的,存在一個黑箱。比如你說Alpha狗贏了李世石和柯潔,但是怎麽贏的,Alpha狗自己也講不明白。Many Artificial intelligence (AI) and machine learning (ML) models are criticized for being 「black box,」 that is, unable to explain why the features (e.g., biomarkers) have been selected by the model.
此外,數據和程式碼的不透明/不公開,使得很多結果沒有辦法重復或驗證。lacking appropriate transparency on data and code, lacking adequate comparator groups, and deviating from existing reporting standards can jeopardize reliability.
挑戰4:開發準確的檢測技術
我知道要檢測哪個標誌物後,我要用什麽方法檢測。這就好比,知道目的地後,我怎麽到達目的地。我可以走到北京去,也可以坐高鐵去,還可以坐飛機去,哪種方式最準確、最安全、最合理、價效比最高呢?這也是腫瘤檢測需要考慮的。
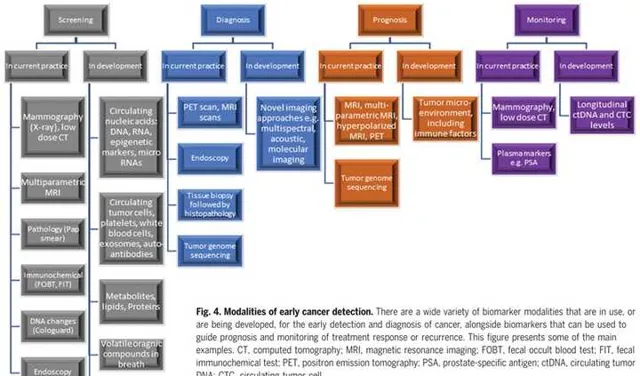
早期檢測的一個重要目的是檢測到對治療易感,而且不易轉移的腫瘤。這種時期的早期腫瘤,其直徑在公釐級,含有10萬~100萬個細胞,這對檢測精度的要求就很高。絕大多數的影像學技術不能檢測到這麽小的腫瘤,但最新的體內成像裝置,比如10.5T的磁共振成像(MRI)在不斷迫近這個極限。
除了影像學,在組織病理學和人工智慧方面的進步也將提高檢測的精準性。組織病理是診斷和預後階段確認的關鍵。人工智慧的引入,可以提高敏感性,在一定程度上降低主觀性以及內部的偏差。
挑戰5:合理評估早期檢測方法
找到好的標誌物,有了好的檢測技術,那麽如何評估這套檢測方案的有訊息呢?這個時候臨床試驗的設計顯得至關重要。Trials must be carefully designed to address the relevant population and measure the appropriate end points to provide statistically robust evidence to change practice.
一個好的標誌物,並不是對所有臨床場景都適用,合適的才是最好的,因此關鍵在於透過合理的臨床試驗設計,找到最適宜的臨床套用場景。在設計臨床試驗的時候,需要選擇恰當的目標人群,選擇合適的臨床終點,統計學專家來計算樣本量,還要盡可能消除各種偏倚,比如疾病譜偏倚(描述疾病異質性的一個術語,是指診斷或篩檢試驗的靈敏度和特異度在不同的病人亞組間);試驗結果出來後,還要對結果進行合理恰當的解讀。
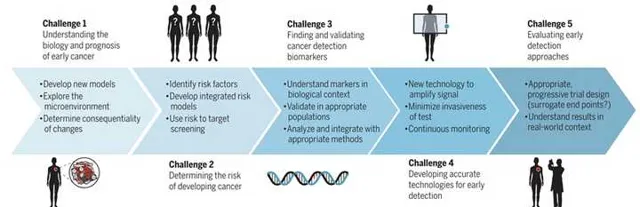
綜上,這5大挑戰可用下面這張圖總結。
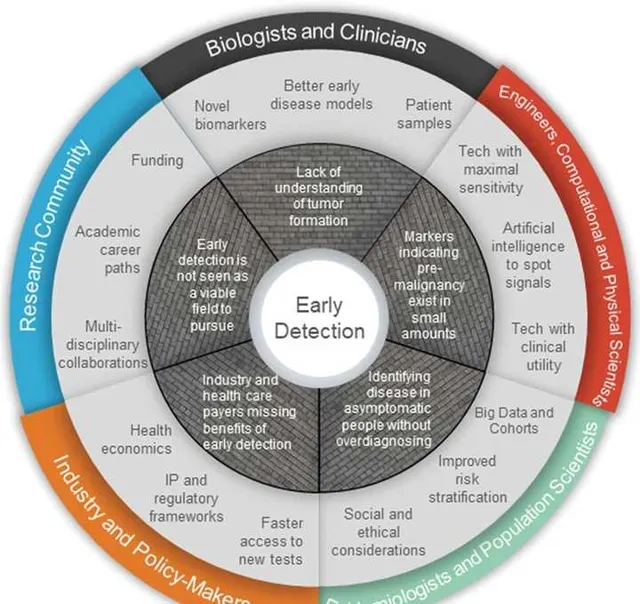
要做到腫瘤早期檢測並不容易,不僅要克服以上5個核心的挑戰,還要各方的參與。比如生物學家和臨床醫生,繼續研究腫瘤的生物學特性,找到新的腫瘤標誌物;對於工程師、計算學家和物理學家而言,開發人工智慧技術或其他新的科技,助力早期腫瘤訊號的檢測;對於流行病學專家和人類學科學家,需要鑒定腫瘤的易感因素,從而鑒定出腫瘤的易感人群;對於工業界和政府決策人員,需要加速腫瘤早期檢測的實施,並註重健康經濟學;對於研究團體而言,需要不斷註入科研經費,鼓勵多學科的合作,共同推動腫瘤早期檢測的進展。
相關數據連結:
1. WHO的Guide to Cancer Early Diagnosis報告:https:// apps.who.int/iris/handl e/10665/254500
2. 文中英國數據來源:Office for National Statistics UK, Cancer survival in England: adult, stage at diagnosis and childhood - patients followed up to 2018, 12 August 2019; www.ons.gov.uk/peoplepopulationandcommunity/healthandsocialcare/conditionsanddiseases/bulletins/cancersurvivalinengland/stageatdiagnosisandchildhoodpatientsfollowedupto2018.
3. 文中美國數據來源:https://seer.cancer.gov
4. International Agency for Research on Cancer (IARC,國際癌癥研究機構): https:// survcan.iarc.fr/indexsu rvcan1.php
5. 國際癌癥基準夥伴關系(International Cancer Benchmarking Partnership, ICBP): https:// gco.iarc.fr/survival/su rvmark









