有人說,癌細胞就像是貪婪的吸血鬼,在人體裏不斷爭奪營養,用來促進自己的生長。不過,癌細胞也有「敵人」。
癌細胞被「餓死」
有人設想,如果能堵住癌細胞的嘴,是不是就能餓死癌細胞,治療癌癥?
從生理上看,癌細胞需要一種叫做谷氨醯胺的胺基酸,它對於合成DNA、蛋白質以及脂類來說都有重要的作用。早在20世紀50年代,科學家們就開發了一種叫做DON的藥物,能有效抑制那些使用谷氨醯胺的酶,從而讓癌細胞無法「吃掉」 谷氨醯胺。這樣一來,癌細胞就會被餓死。
然而一系列臨床試驗表明,這種藥物的毒副作用極大。這也可以理解。癌細胞需要谷氨醯胺,正常細胞也需要呀。把DON就這麽直接用到身體裏,那還不得影響到正常細胞?
為此,科學家換了一個思路。他們使用的是DON的「前藥」;也就是說,只有經過額外的代謝,「前藥」才會變成DON。在普通的情況下,這種「前藥分子」會在血液裏迴圈而不發揮效果;但在腫瘤微環境中,這種分子的結構會發生改變,變成抑制谷氨醯胺吸收的DON。這樣一來,我們可以把藥物的效果僅僅控制在腫瘤附近。
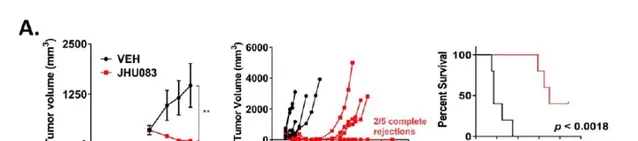
這種「前藥分子」,真的能在動物體內起到抗癌效果,且不帶來嚴重副作用嗎?為了回答這個問題,科學家們使用了多種不同的小鼠癌癥模型,它們分別被註射了結直腸癌、淋巴瘤、以及黑色素瘤。研究結果表明,在這種藥物的治療下,腫瘤體積均有明顯縮小,小鼠的生存期也有所延長。相比之下,對照組的腫瘤體積最多可達治療組的5倍。
更令人欣喜的是,後續研究表明,治療組之所以取得那麽好的效果,一方面要歸功於抑制癌細胞對谷氨醯胺的吸收,另一方面則是因為免疫T細胞不受這種藥物的影響。
這倒不是說這種藥物分子對T細胞不起效。相反,它同樣能夠抑制T細胞對谷氨醯胺的吸收。但T細胞有著多條生化通路可以使用,一條被抑制了,可以使用另一條來合成DNA等關鍵分子,而癌細胞則沒有這種能力。
溶瘤病毒
【科學】子刊【科學轉化醫學】(Science Translational Medicine)曾發表了一項關於溶瘤病毒的新進展。科學家們發現,在小鼠模型中,這種經過基因改造的病毒能夠有效對視網膜母細胞瘤進行治療。在人類患者裏,它也取得了積極的初步結果。
視網膜母細胞瘤是一種病發於視網膜的癌癥。事實上,它也是3歲以下兒童裏最為常見的癌癥之一。關於它的病理,科學家們已經有了一定的了解——由於體內的抑癌基因RB1的失活,癌細胞開始不受控制地生長。目前,對於這種兒童癌癥最為常見的治療方式就是化療。這不但會對兒童視網膜造成損害,效果也不盡如人意。如果化療不成功,這些年幼的患者就不得不摘除眼球,保全性命。
在本文開頭提到的這項研究裏,一支由西班牙科學家主導的跨國科研團隊決定對病毒進行改造,讓它們殺死癌細胞。使用病毒治療癌癥的方法並不罕見。事實上,溶瘤病毒也是許多研究人員們所專註的重點。本研究中,科學家們選擇的是「腺病毒」,這是一種會引起呼吸道輕微感染的病毒,以前常在基因療法中作為病毒載體,用於人體。
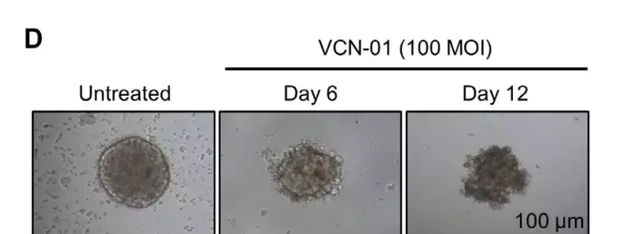
當然,這種腺病毒也得到了科學家們的遺傳改造。經過改造後,它們在體外實驗中,能感染和殺死那些RB1訊號通路失活的細胞,而這正是視網膜母細胞瘤病發的根源之一。
這些積極的結果,激勵科學家們進一步開展了小鼠實驗。在患有視網膜母細胞瘤的小鼠眼球裏,他們也註射進了這種病毒。實驗表明,這種病毒能對腫瘤產生一定的殺傷效果。與常規的化療相比,它更是能延長眼球的生存期,並防止癌癥往大腦轉移。

在健康的兔子裏,研究人員們又測試了這種療法的安全性。他們發現,盡管兔子的眼部出現了一些炎癥和積液,但病毒並沒有擴散到全身,表明其具有安全性。另外,這些副作用也在6周內逐漸消失,沒有帶來嚴重的影響。
基於這些初步實驗結果,研究人員們決定在人類身上評估安全性和治療效果。他們招募了兩名已經接受了化療,但疾病依舊出現進展、且無藥可用的兒童視網膜母細胞瘤患者。在患者身上,研究人員們發現這種病毒並沒有引起嚴重的系統性反應,再次表明了其安全性。在有效性方面,一名患者體內也出現了明顯的抗腫瘤反應——視網膜母細胞瘤會在眼球中留下叫做「玻璃體種子」的小腫瘤塊,而這種經過改造的溶瘤病毒可以減少這些「玻璃體種子」的數量與體積。
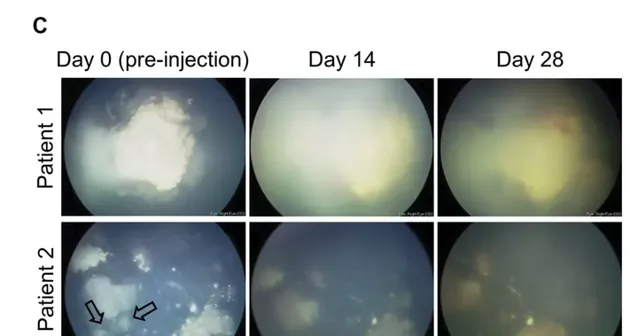
不過這種病毒也並非「神藥」。在研究中,這些病毒並沒能直接殺死視網膜母細胞瘤,兩名患者最終也不得不接受手術,摘除了他們的眼球。研究人員指出,是否提高病毒劑量就能進一步提高療效。為了驗證這個想法,他們也將盡快啟動臨床試驗,以期讓這款病毒療法造福無法透過化療改善病情的兒童患者。
抑制癌細胞「自噬」
與滯育的胚胎相似,處於緩慢分裂狀態的癌細胞,需要啟用一種叫做「自噬」(autophagy)的細胞過程;它們會迴圈使用自身的蛋白質或細胞成分,以便在化療導致的惡劣環境中活下去。
順著這個思路,研究人員發現了治療的機會:如果在化療中幹擾癌細胞的自噬,是不是就能降低癌細胞的生存能力,避免癌癥的復發?
後續實驗證實了這一點。研究人員測試了一種抑制自噬的小分子化合物,而失去自噬功能的癌細胞,終於被化療藥物成功殺死。
癌細胞「同類相食」
來自美國杜蘭大學(Tulane University)醫學院的一項研究發現,癌細胞竟然會透過「吞食鄰居」的方式躲過化療。
通常情況下,化療藥物可以破壞癌細胞的DNA,從而將快速增殖的癌細胞殺死。然而,過去的研究表明,有些癌細胞會停止分裂,進入一種不死不活的「衰老」狀態。衰老的癌細胞保持著活躍的新陳代謝,是癌癥日後復發的大患,與患者的不良預後大有關系。
在這項研究中,科學家首先觀察了乳癌細胞在暴露於化療藥物阿黴素(doxorubicin)或紫杉醇(paclitaxel)時的狀態。他們設計了一種熒光標記方法,讓癌細胞帶上紅、綠不同的顏色,從而方便辨識鄰近的不同細胞。透過延時和共聚焦顯微鏡,他們驚訝地發現,進入衰老狀態的癌細胞,竟然在頻繁地吞噬著鄰近的癌細胞。
不僅乳癌細胞會這麽做,移植到小鼠體內的其他類別腫瘤,包括肺癌細胞和骨肉瘤細胞,也會在暴露於化療藥物後吞吃相鄰的癌細胞。
有專家認為,癌細胞的同類相食,可能是一種與衰老狀態相關的普遍行為,而不局限於特定的癌癥或特定基因。
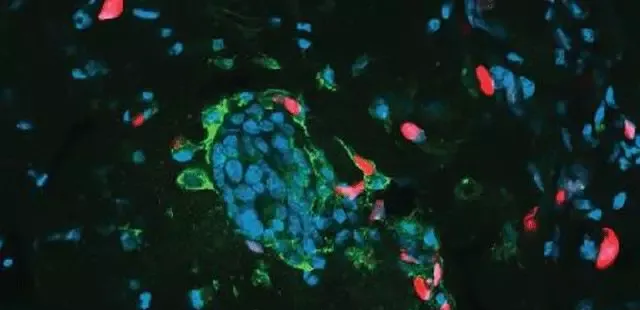
仔細觀察被吞噬的癌細胞,它們有些是不死不活的衰老細胞,有些則還活得好好的。用研究者的話說,一些癌細胞是被「活活生吞」了。
研究人員還透過基因測序證明,衰老癌細胞確實增加了吃細胞的能力。根據它們表達的基因來看,通常在巨噬細胞(一種白細胞,專長吞噬)吞噬入侵微生物或細胞碎片時活躍的基因,在衰老癌細胞中也活躍起來。
癌細胞同類相殘有什麽好處呢?接下來就是這項工作的亮點了。研究人員觀察到,吃掉鄰居的衰老癌細胞可以在培養基中活更長的時間。
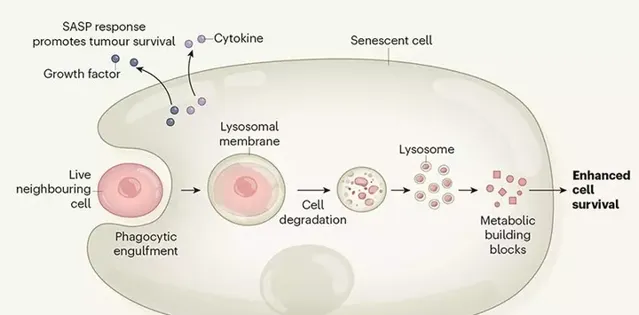
進一步分析顯示,被吞掉的鄰居會在衰老癌細胞的內部被送去特殊的消化裝置——溶酶體。在那裏,被吞噬的細胞分解,相當於提供了一場代謝物大餐。
研究者認為,癌細胞借助同類相食獲取賴以生存的能量和物質,待到化療結束還能引發腫瘤復發。基於這些發現,抑制這一過程,也特許以提供新的治療機會。
參考資料:
[1] Robert D. Leone et al., (2019), Glutamine blockade induces divergent metabolic programs to overcome tumor immune evasion, Science, DOI: 10.1126/science.aav2588
[2] Revamped cancer drug starves tumors in mice, Retrieved November 7, 2019, from https://www.sciencemag.org/news/2019/11/revamped-cancer-drug-starves-tumors-mice
[3] Guillem Pascual-Pasto et al., (2019), Therapeutic targeting of the RB1 pathway in retinoblastoma with the oncolytic adenovirus VCN-01, Science Translational Medicine, DOI: 10.1126/scitranslmed.aat9321
[4] Crystal A. Tonnessen-Murray et al., (2019) Chemotherapy-induced senescent cancer cells engulf other cells to enhance their survival. Journal of Cell Biology DOI: http://doi.org/10.1083/jcb.201904051
[5] Michael Overholtzer (2019) Senescent cells feed on their neighbours. Nature. DOI: 10.1038/d41586-019-03271-3
▎藥明康德內容團隊編輯
註:本文旨在介紹醫藥健康研究進展,不是治療方案推薦。如需獲得治療方案指導,請前往正規醫院就診。歡迎個人轉發至朋友圈,謝絕媒體或機構未經授權以任何形式轉載至其他平台。
⤵️喜歡這篇內容,歡迎關註@藥明康德,或者點贊、評論、分享給其他讀者吧!











